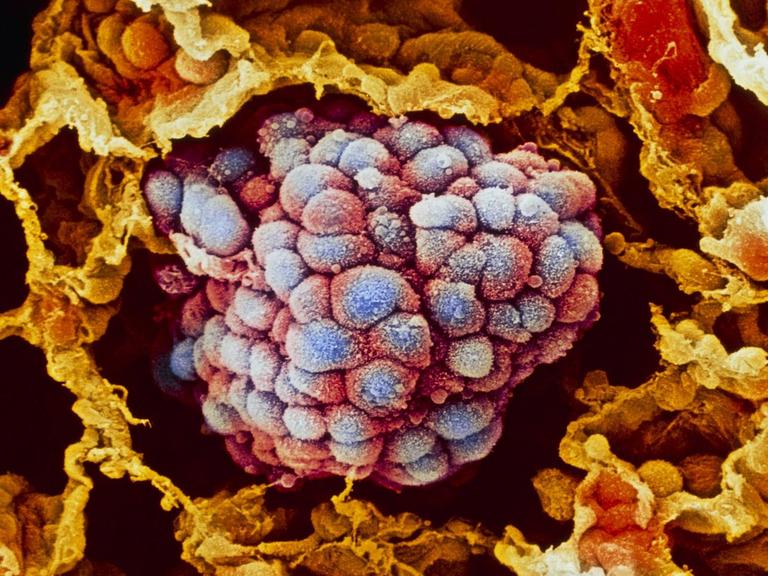
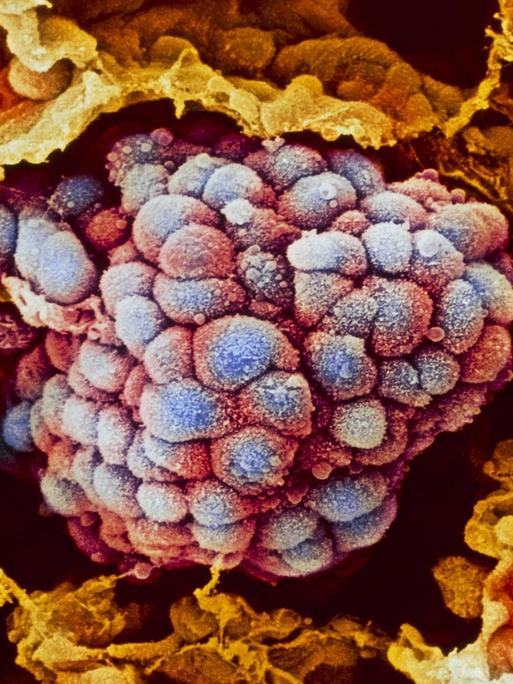
Eine Blutanalyse könnte die Krebstherapie revolutionieren
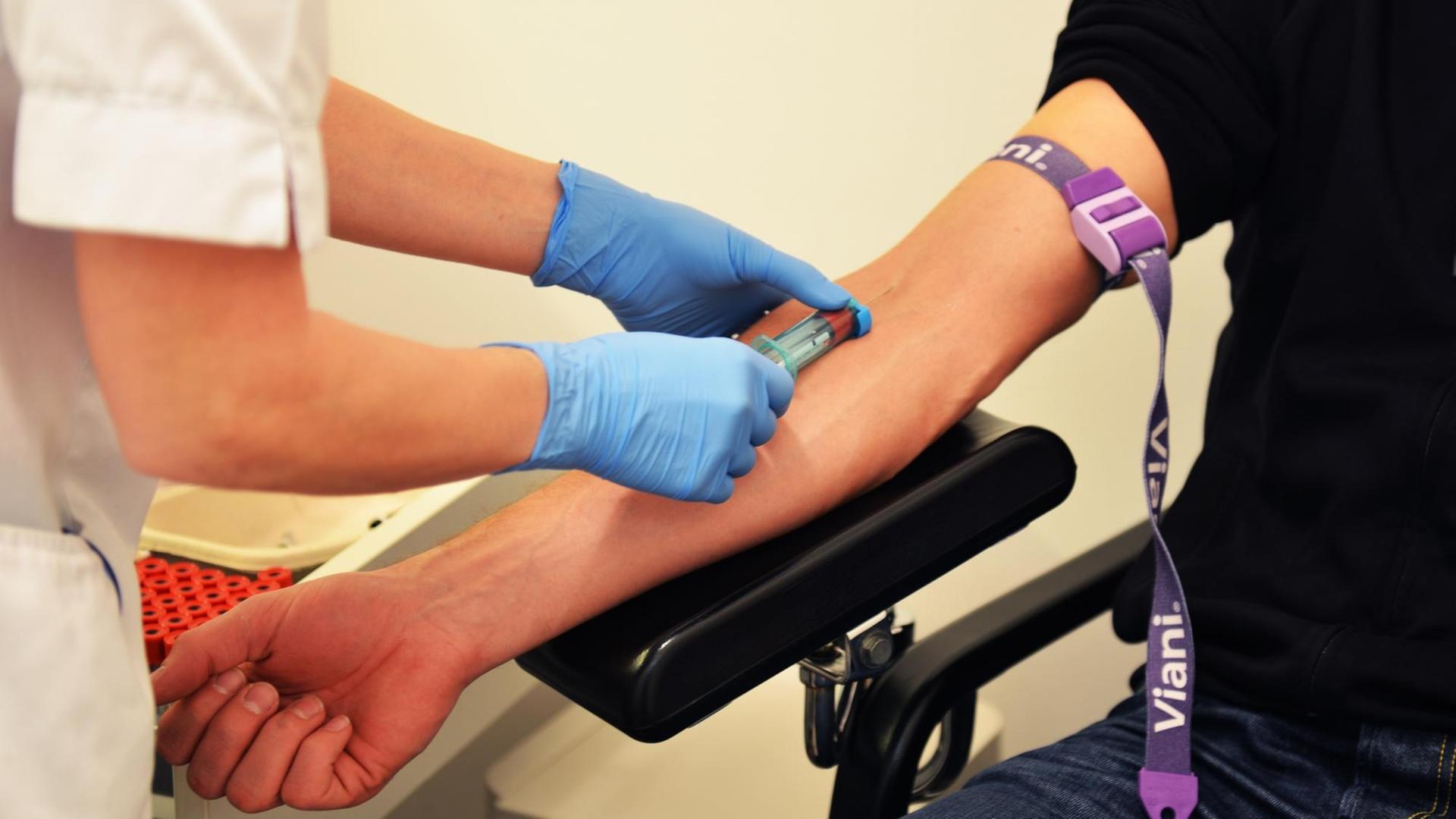
Es klingt simpel und ist doch hoch kompliziert: Um festzustellen, wie sich ein Tumor bei einem Patienten verändert, muss bald nur das Blut untersucht werden. Es ist nicht mehr notwendig, dem Betroffenen eine Gewebeprobe aus dem Körperinneren zu entnehmen.
"Wir glauben, dass der Ansatz der Flüssigbiopsie das Potential hat, die Diagnostik und Behandlung von Erkrankungen zu revolutionieren."
"Ein ganz ganz neues Verfahren, was noch fast Experimental-Charakter hat.Aus medizinischer Sicht eine absolute Revolution."
"Also die Liquid Biopsy ist für mich ein Meilenstein. Wir wollen eigentlich den genetischen Krebsfingerabdruck aus dem Blut bestimmen."
"Für die ganze Therapie ist das super. Eigentlich hat es nur Vorteile."
"Ja, das ist ein echter Fortschritt. Ich denke, dass sich das letztendlich auch durch längere Lebenszeit niederschlagen muss."
Das ist auch die große Hoffnung von Isabel Hillbrandt. Vor rund 3,5 Jahren wurde bei der heute 40-Jährigen ein Tumor im Darm entdeckt.
Hillbrandt: "Da ist man geschockt und muss das erst einmal verarbeiten. Man wird ja so komplett rausgerissen aus allem und das Leben ändert sich natürlich von jetzt auf gleich komplett. Es ging halt alles ganz schnell. Ich wurde dann ja auch direkt operiert und – ja man macht halt alles mit und versucht irgendwie das Beste draus zu machen. Ja von jetzt auf gleich war ich in Behandlung und dann war das Leben komplett anders."
Auch das der kleinen Kinder, die zu der Zeit rund vier und sechs Jahre alt waren.
Hillbrandt: "Also ich wusste, dass ich Darmkrebs jetzt schon im fortgeschrittenen Stadium habe, weil ich in der Lunge und der Leber schon Metastasen direkt hatte. Also Zeitvorgaben oder so etwas wurden jetzt nicht gemacht, aber dass es nicht heilbar ist, dass wusste ich direkt von Anfang an schon. Also so krass haben wir das den Kindern natürlich nicht gesagt. Die wissen das jetzt, dass ich halt krank bin und die gehen da super mit um. Für die ist das jetzt so: ich muss halt meine Medizin kriegen und ich glaube, da sind die erst einmal ganz gut mit bedient."
Natürlich habe sie sich unendlich viele - auch quälende - Gedanken darüber gemacht, wie es weitergeht, mir ihr, mit den Kindern mit dem Partner. Aber darüber möchte sie in der Öffentlichkeit nicht reden. Die Folgen der tödlichen Krankheit sind zu privat. Außerdem überwiegt im Moment die Zuversicht, sagt sie und ihre Augen strahlen.
Hillbrandt: "Also ich hatte auch schon mal ganz schlechte Phasen. Jetzt im Moment geht’s mir eigentlich so gut wie noch nie vorher. Also ich fühle mich eigentlich super gut. Außer dass ich halt alle zwei Wochen hierhin muss, diese Chemo kriegen. Dann fühle ich mich nicht ganz so gut, so ein/zwei Tage. Ich vertrag die im Moment eigentlich ganz gut. Aber es ist auch im Moment insgesamt alles gut."
Gerade ist Isabel Hillbrandt wieder für ein paar Tage im Universitätsklinikum Knappschaftskrankenhaus Bochum. Die nächste Chemobehandlung steht an.
Der genetische Code des Tumors
Alle zwei Wochen kommt sie für die Chemotherapie drei Tage stationär in die Bochumer Klinik. Jedes Mal nimmt ihr Oberarzt Alexander Baraniskin dann Blut ab.
Er ist für die Umsetzung der Flüssigbiopsie im Klinikalltag zuständig.
Arzt: "Sie wissen, wir machen diese Blutabnahme für die Liquid Biopsie-Untersuchung. Und sie wissen, mit dieser Untersuchung möchten wir nachschauen, ob diese Mutationen im Blut vorhanden sind oder nicht. Zuletzt waren sie ja nicht nachweisbar. Also falls wir einen Progress sehen, könnten wir mit dem Antikörper wieder starten. Wir hoffen aber, dass die Erkrankung stabil bleibt. Es ist wichtig für uns, die Daten zu sammeln, um den Verlauf beobachten zu können."
Patient: "Okay, aber wenn die Untersuchung jetzt keinen Progress ergibt, würden wir so wie es jetzt ist weitermachen?"
Arzt: "Würden wir so, wie es jetzt ist weitermachen."
In der Nähe ihres Schlüsselbeines hat die zierliche Frau mit den kurzen dunklen Haaren, die vor der Chemo noch sehr lang waren, einen Port, also einen dauerhaften Zugang zu ihrem Blutsystem. Über diese Kanüle träufeln die Medikamente der Chemotherapie dann langsam in ihren Körper und verteilen sich überall. Isabel Hillbrandt soll eine möglichst individuelle Therapie bekommen, die - so gut es geht - auf die Beschaffenheit ihres ganz speziellen Tumors ausgerichtet ist, betont Chefarzt Wolff Schmiegel:
"Sie ist entscheidend darüber, wie lange ein Patient von einer medikamentösen Tumortherapie profitiert, wie lange sein Überleben mit einer Krebserkrankung sein wird. Diese Treffgenauigkeit kann nur funktionieren, wenn wir so viele Informationen wie möglich haben."
Und zwar Informationen aus dem Innersten des Tumors, aus der Krebszelle. Es geht um die molekulare Beschaffenheit des Tumors, um seinen genetischen Code. Denn aus der Tumor-DNA können Pathologen herauslesen, ob der Krebs sich verändert hat, ob er Mutationen entwickelt hat, die dazu führen können, dass das gerade verabreichte Medikament nicht mehr wirkt.
Schmiegel: "Wenn wir beim Darmkrebs wissen, wie das Mutationsspektrum ist, wie dieser genetische Fingerabdruck ist, dann können wir darauf die richtigen Medikamente setzen und wir können für das Gesamtüberleben des Patienten einen enormen Sprung nach vorne machen."
Denn diese personalisierten Medikamente blockieren - nach dem Schlüssel-Schloss-Prinzip - die für das Wachstum verantwortliche Stelle im Tumor. Sie wirken aber nur, wenn ein bestimmtes Gen aktiv ist. Deshalb ist die Genanalyse von Tumorgewebe in der Krebsbehandlung heute Routine.
Schwierigkeiten bei der Tumoruntersuchung
Allerdings ist es oft sehr schwierig, und für die ohnehin geschwächten Patienten mitunter sehr gefährlich, an das Tumorgewebe heranzukommen. In einfachen Fällen wird unter örtlicher Betäubung zum Beispiel mit einer Hohlnadel durch die Bauchdecke bis in den Lebertumor gestochen und ein winziges Stück Gewebe heraus gestanzt. Sitzt der Tumor an einer nicht so leicht zugänglichen Stelle des Körpers, ist sogar eine Operation samt Vollnarkose notwendig. Ein enormer invasiver Eingriff also, der riskant, teuer und nicht immer von Erfolg gekrönt ist. Dazu kommt erschwerend: Die genetische Zusammensetzung eines Tumors ist nicht an allen Stellen gleich, erklärt Alexander Baraniskin.
Baraniskin: "Das heißt, es kann durchaus sein, dass ein Bereich Zellen die mutiert sind enthält, und im anderen Bereich sind die nicht mutierten Zellen."
Für eine aussagekräftige Analyse müsste der Arzt mit der Punktionsnadel tatsächlich genau in den Teil des Tumors stechen, der die therapieentscheidende DNA-Information beinhaltet. Entnimmt er das Gewebe ein paar Millimeter weiter links oder rechts, kann das zu einem komplett anderen Analyseergebnis führen. Und schlimmstenfalls eben auch zu einer falschen Therapie, die dem Patienten keinerlei Nutzen beschert. Die Nebenwirkungen hätte er trotzdem.
Baraniskin: "Und dann gibt es auch Unterschiede zwischen den einzelnen Metastasen. Es kann sein, dass die Lebermetastase ganz andere biologische Eigenschaften hat, als die Lungenmetastase. Das heißt, wenn wir eine reine Biopsie machen, also eine Gewebeentnahme durchführen, dann haben wir nur einen kleinen Ausschnitt des Tumors gewonnen. Und mittels Liquid Biopsy gewinnen wir sozusagen eine Aussage über die Gesamtmutation des Tumors."
Denn analysiert wird jetzt nicht mehr das Gewebe, was an einer einzigen Stelle des Tumors entnommen wurde, sondern das Blut des Krebspatienten. Die Idee klingt simpel, so wie sie Michael Kazinski beschreibt. Er ist beim weltweit führenden Biotechnologieunternehmen Qiagen im nordrhein-westfälischen Hilden für den Bereich der Flüssigbiopsie verantwortlich.
Kazinski: "Tumore unterscheiden sich von gesunden Zellen, dadurch dass sie deutlich schneller wachsen. Bei denen ist einfach das genetische Programm aus den Fugen geraten. Diese Zellen sterben tatsächlich auch schneller und entlassen ihren genetischen Inhalt in den Blutstrom. Und im Blutstrom wird diese genetische Information auch verdaut, zerkleinert. Das heißt, dass, was wir messen im Blut, ist tatsächlich die DNA von sterbenden oder gestorbenen Tumorzellen."
Und zwar nicht nur die des Haupttumors. Auch die Metastasen geben Krebs-DNA ins Blut ab. Im Blut von Isabel Hillbrandt schwimmen also Erbinformationen aus ihren Krebsherden im Darm, in der Lunge und in der Leber. Und sie alle werden bei der Blutuntersuchung in einem einzigen Schritt auf Mutationen analysiert, betont Wolff Schmiegel.
Schmiegel: "Der Test, über den wir jetzt sprechen, der ist zugelassen. Die Übereinstimmung liegt bei 93 Prozent im Vergleich Gewebediagnostik mit Liquid Biopsy. Besser geht es nicht! Und das ist so wie Sonntag beim Tatort: wir wollen eigentlich den genetischen Fingerabdruck aus dem Blut machen und wollen die Krebsspuren, den Krebsfingerabdruck, aus dem Blut bestimmen. Das ist eigentlich das wichtige und der Quantensprung."
Wie ist die medizinische Revolution möglich?
Das spricht ganz eindeutig für den Einsatz der Flüssigbiopsie, sagt der Arzt Alexander Baraniskin, denn es erspart seiner Patientin Isabel Hillbrandt mitunter risikoreiche Eingriffe.
Baraniskin: "Bevor diese Methodik vorhanden war, musste Frau Hillbrandt mehrfach punktiert werden, um diese Frage zu beantworten. Und seitdem wir diese Methode haben, sind die wiederholten Punktionen überflüssig geworden."
Hillbrandt: "Eine Leberpunktion habe ich einmal gehabt. Ist nicht so angenehm. Wenn man es öfter machen muss, ist es schon angenehmer, wenn man es übers Blut bestimmen kann."
Baraniskin: "Ein Nachteil von der Liquid Biopsy ist, dass wir dann letztlich gar nicht wissen, welche Raumforderungen mutiert sind und welche nicht. Wir haben Mutation gesehen, aber wir wissen nicht, ob diese Mutationen von der Lungen- oder von der Lebermetastase kommen."
Eine Information, die die Ärzte aber nur dann zwingend wissen müssten, wenn sie die Tumore chirurgisch entfernen oder sie bestrahlen wollten.
Baraniskin: "Aber letztendlich, es geht ja um die systemische Chemotherapie. Und die wirkt ja überall. Das heißt, welche mutiert sind und welche nicht, spielt letztlich keine große Rolle."
Dass Primärtumore und Metastasen ganze Krebszellen oder winzige Fragmente von Krebs-DNA ins Blut abgeben, ist keine neue Erkenntnis, räumt Reinhard Büttner ein. Er leitet das Institut für Pathologie an der Kölner Universitätsklinik und spricht hier auch für den Bundesverband Deutscher Pathologen. Doch erst die rasante Technologieentwicklung mit hochsensitiven und automatisierten Testverfahren gepaart mit neuen Erkenntnissen aus der Grundlagenforschung macht diese medizinische Revolution möglich.
Büttner: "Jetzt gehen wir in eine Zeit,wo es zunehmend möglich wird, am Krebsgenom herauszufinden, welches Medikament blockt eine Veränderung, die nur in der Krebszelle vorliegt. Deswegen sprechen wir auch von zielgerichteten oder targeted Therapien. Die sind wesentlich nebenwirkungsärmer und im Effekt höher als die ungerichteten Chemotherapien. Dieses zielgerichtete Prinzip ist eine Revolution, weil man erstmalig an den Ursachen der Kerbserkrankung entlang eine Therapie orientieren kann."
Präzise Informationen aus der Krebszelle
Durch das Entschlüsseln des genetischen Codes gewinnen Pathologen, Laboranten und Ärzte überlebenswichtige Informationen aus der Krebszelle, die eine möglichst präzise und möglichst nebenwirkungsarme Behandlung von Krebspatienten erlaubt. Das Wissen, nach welchen Mutationen die Experten im Blut der Krebspatienten suchen müssen, ist in internationalen Datenbanken gesammelt.
Büttner: "Es hat ein großes internationales Konsortium gegeben, die haben tausende von Darm-, Lungen- und Brustkrebsgenomen durchsequenziert. Und man hat gelernt, was sind die typischen Veränderungen bei diesen Tumorarten. Und das zeigen alle klinischen Studien – das ist möglich am Blut. Weil diese Resistenzmutationen im Blut auftauchen und dann ein Alarmsignal sind dafür, dass die Therapie umgestellt werden muss."
Im Knappschaftskrankenhaus Bochum sucht man im Blut von Isabel Hillbrandt alle paar Wochen nach genau diesen Veränderungen.Um der Mutter von zwei Kindern trotz ihrer massiven Krebserkrankung möglichst viel Lebensdauer und auch Lebensqualität bieten zu können, wird die Wirkung der Chemotherapie engmaschig kontrolliert.
Hillbrandt: "Also ich bekomme ja jedes Mal, alle zwei Wochen wenn ich hier bin, sowieso Blut abgenommen. Und dann wird halt für die Studie Blut gleich mit abgenommen. Das ist für mich kein Extraaufwand. Die Metastasen kommen halt immer wieder. Auch trotz der OPs. So dass man diese Chemo jetzt macht, um den Tumor in Schach zu halten. Und das halt immer regelmäßig durch die Kontrolluntersuchungen beobachtet, um so lange wie möglich noch Lebezeit zu gewinnen."
Allerdings lauern auf dem Weg bis zur aussagekräftigen Analyse einige Hürden. Das fängt schon bei der Blutabnahme an. Denn ob das Röhrchen mit dem Blut geschüttelt wird oder nicht, ob es direkt in den Kühlschrank kommt oder erst 30 Minuten später – all das hat Einfluss auf die darin schwimmenden winzigen DNA-Stückchen. Das Verfahren der Flüssigbiopsie ist so neu, dass es schlicht noch keine einheitlichen Qualitätsstandards und Richtlinien gibt, betont der Pathologe Reinhard Büttner.
Büttner: "Alle Daten, die wir heute haben, kommen aus klinischen Studien, wo hochgeschulte Experten alle diese Schritte gemacht haben. Unsere Beobachtung ist, wenn das Ganze in der realen Welt ankommt, wenn Blutproben gewonnen werden, von Menschen, die sich der Problematik nicht bewusst sind, die das machen, als ginge es um die Bestimmung eines Kaliumwertes, dann sehen wir häufig eine Qualitätseinschränkung der Aussage."
Blutproben gehen quer durchs Land
Und selbst wenn bei der Blutentnahme alles richtig gemacht wird, muss es schnell gehen, denn die Krebs-DNA-Fragmente im Blut sind sehr vergänglich. Schon nach zwei Stunden sind sie in der Blutprobe nicht mehr nachweisbar. Doch bislang gibt es kaum Labore, die die Liquid Biopsy durchführen. Und so müssen die Blutproben quer durch die Republik geschickt werden – was länger als zwei Stunden dauert. Ein Dilemma, für das die Hildener Pharmafirma Qiagen nach einer Lösung gesucht hat. Heraus kamen Blutabnahmeröhrchen, die mit einem bestimmten chemischen Zusatz versehen sind, erklärt Biotechnologe Michael Kazinski.
Kazinski: "Und diese Chemie sorgt dafür, dass diese kleinen Fragmente von DNA stabilisiert werden im Blut. Das heißt, dass Profil, was von den Tumorzellen abgegeben wird ins Blut, wird dadurch konserviert, "unabhängig" von den Lagerbedingungen. Also sie können sechs Tage bei Raumtemperatur mit unserer Lösung die Proben durch die Gegend schicken und trotzdem wird sich das Profil nicht wesentlich verändern."
Rund zehn Jahre hat alleine die Entwicklung dieser speziellen Blutabnahmeröhrchen gedauert, die jetzt gerade auf den Markt kommen. Sie ergänzen die bereits zugelassen Blutanalysetests, deren Zahl in Zukunft rasch steigen wird, ist Michael Kazinski sicher. Weltweit forschen die Biotechfirmen mit Hochdruck an neuen Testverfahren für den klinischen Alltag.
Kazinski: "Wir schätzen den Markt im mittleren dreistelligen Millionenbereich zum heutigen Zeitpunkt ein. Wenn sie einen zugelassenen Test haben in einer weit verbreiteten Tumorerkrankung, nehmen sie Lungenkrebs, nehmen sie Magenkrebs, reden wir über einen Milliardenmarkt."
Um an die reine Nukleinsäure des Tumors zu gelangen, durchläuft die Blutprobe von Krebspatienten wie Isabel Hillbrandt ein ausgeklügeltes, hochtechnisiertes Verfahren, bei dem in mehreren Schritten mit unterschiedlichen chemischen Zusätzen vollautomatisiert alle unerwünschten Bestandteile im Blut entfernt werden.
Übrig bleibt die hochreine DNA des Tumors - allerdings in verschwindend geringer Menge. Um sie aussagekräftig analysieren zu können wird sie vervielfacht und dann - in einem letzten Schritt - ausgelesen.
Damit die ganz speziellen Veränderungen in einem Tumor möglichst treffsicher identifizieren werden können, reicht es derzeit aber noch nicht aus, nur im Blut nach der Tumor-DNA zu suchen. Noch brauchen die Ärzte weiterhin auch die Analyse des Tumorgewebes – quasi als Basis für die Liquid Biopsy, betont der Pathologe Reinhard Büttner.
Büttner: "Weil die korrekte Interpretation der Mutationen voraussetzt, dass ich aus dem Gewebe schon die primären Mutationen kenne."
Flüssigbiopsie wird noch selten angewendet
Im Moment wird also eine Tumorgewebebiopsie zu Beginn der Krankheit gemacht und für die Überwachung der Erkrankung möglichst die schonende aber aussagekräftige Flüssigbiopsie eingesetzt.
Büttner: "Die Daten, die wir haben, die überwiegend aus großen internationalen Studien stammen, sehen sehr gut aus. Wenn die Blutentnahme eine Resistenzmutation anzeigt, braucht man keine weitere Gewebeentnahme. Das heißt, der Patient hat einen echten Benefit."
Ein Gewinn, der allerdings für die meisten Krebserkrankungen noch in weiter Ferne liegt. Im Moment wird die Flüssigbiopsie nur im Rahmen von Studien und an ausgewiesen Krebszentren eingesetzt. Zudem konzentrieren sich die Forscher weltweit auf die häufigsten und tödlichsten Krebsarten: Lungenkrebs, Darmkrebs und Brustkrebs.
Schmiegel: "Wir pirschen uns mehr und mehr daran. Bei Lungenkrebs gibt es vielleicht noch 60 Prozent der Tumore, wo man die molekulare Signatur nicht kennt. Das heißt bei 40 Prozent kennt man sie schon! Bei Darmkrebs sind wir ein bisschen schlechter."
Mediziner und Forscher entdecken zwar durch die extrem sensiblen Mess- und Analyseverfahren ständig neue Mutationen und Resistenzen, aber sie können sie nicht immer deuten, erläutert Ursula Marschall von der Barmer-Krankenkasse.
Marschall: "Es ist so, dass wir fast alle drei Monate eine neue Mutation entdecken, ohne dass wir bisher schon sagen können, sind die tatsächlich klinisch relevant. Also haben diese Mutationen überhaupt etwas damit zu tun, dass der Tumor weiter wächst? Da brauchen wir Studien, damit wir diese Fragen weiter beantworten können."
Und auch die Pharmafirmen hinken hinterher, denn es gibt noch längst nicht für alle entschlüsselten Mutationen ein entsprechendes Medikament.
Marschall: "Diese Identifizierung von Erbinformationsmaterial geht so rasend schnell, dass auch die Arzneimittelhersteller gar nicht hinterher kommen. Und das nächste Problem, was wir ja jetzt durch die Liquid Biopsy entdeckt haben, ist, dass ja diese Tumorzellinformationen sich ja auch wieder verändern können. Das heißt, ich habe jetzt gerade ein neues Medikament eingenommen und Schwups ist mein Tumor mutiert. Was mache ich jetzt?"
Mutiert der Tumor während der Behandlung erneut, schadet das eben noch wirksame Medikament unter Umständen nur noch. Denn nur wenn der individuelle genetische Code samt Mutationen und Resistenzen bekannt ist, kann die Präzisionstherapie helfen. Ärzte müssten also bestenfalls ständig den aktuellen Zustand der Tumore kennen, um möglichst früh auf Veränderungen reagieren zu können. Für eine engmaschige Kontrolle ist die Gewebeprobe jedoch zu belastend und die bildgebenden Untersuchungen zeigen nur Geschwulste, die schon eine gewisse Größe haben.
Schmiegel: "Wenn wir nach der DNA gucken, kriegen wir die Informationen sechs bis acht und manchmal noch mehr Wochen früher, als mit allen herkömmlichen Methoden. Wir machen quasi ein Monitoring im Blut. Wir kriegen jetzt plötzlich einen anderen Zugang zur Kebserkrankung."
Zahlt die Krankenkasse?
Das führt dazu, sagt Chefarzt Wolff Schmiegel, dass Patienten wie Isabel Hillbrandt entweder früher ein anderes Medikament bekommen oder das unwirksame Mittel abgesetzt wird. Damit erspart man ihr zumindest die Nebenwirkungen. Ein Fortschritt, den die 40-jährige Darmkrebspatientin deutlich spürt.
Hillbrandt: "Sonst musste man das halt immer ausprobieren, immer sechs Gaben und dann wurde wieder die nächste Untersuchung gemacht. Das sind ja dann auch immer drei Monate, die man so verstreichen lässt und warten muss, hat es jetzt was gebracht oder nicht. Und wenn man jetzt schon vorher weiß, anhand des Blutes, diesen Antikörper müssen wir jetzt nehmen, dann hat man halt so im Kopf auch schon ein besseres Gefühl, dass es nicht so ein Ausprobieren ist. Dann ist man so ein bisschen motivierter vielleicht auch."
Damit wirklich viele Krebspatienten von den Vorteilen der flüssigen Biopsie und der damit möglichen individualisierten Therapie profitieren können, müsste sie von den Krankenkassen bezahlt werden. Doch das wird sie nicht, erläutert Ursula Marschall, Leiterin der Abteilung Medizin und Versorgungsforschung bei der Barmer GEK in Wuppertal.
Marschall: "Wir dürfen als Krankenkasse nur dann bezahlen, wenn diese neue Untersuchungs- und Behandlungsmethode vom Gemeinsamen Bundesausschuss positiv bewertet wird. Erst dann wird sie in den EBM-Katalog aufgenommen mit einer entsprechenden Ziffer."
Der EBM ist der einheitliche Bewertungsmaßstab. Er regelt, was gesetzliche Krankenkassen bezahlen dürfen und was nicht.
Marschall: "Um eine Ziffer im EBM-Katalog zu bekommen, müssen jahrelange Studien vorliegen. Das heißt, ehe eine Ziffer im EBM-Katalog aufgenommen werden kann, ist es fast schon keine Innovation mehr, weil es schon halb Regelversorgung ist, zumindest haben wir schon längere Erfahrung. Soweit sind wir bei der Liquid Biopsie noch nicht."
Angesichts dieser bürokratischen Logik wurde die noch sehr neue Flüssigbiopsie bei der letzten Novellierung des EBM-Kataloges im Juni 2016 ausdrücklich ausgeschlossen. Bis auf weiteres ist eine Kostenübernahme durch die Krankenkassen also nicht möglich – und das, obwohl Gesundheitsminister Hermann Gröhe erklärt hat, diagnostische Verfahren der personalisierten Medizin besser erstatten zu wollen. Das treibt dem Arzt Wolff Schmiegel Zornesfalten ins Gesicht.
Schmiegel: "Eine individualisierte oder zielgerichtete Krebstherapie kann es nur mit der Liquid Biopsy geben. Wer die Liquid Biopsy nicht in den Leistungskatalog aufnimmt, der blockiert diesen Fortschritt für die Patienten. Denn wir haben mehr Möglichkeiten, heute Krebs besser zu behandeln, als wir einsetzten dürfen. Und da einfach zu sagen, das gibt’s nicht, nimmt mir den Atem. Sage ich ihnen ganz offen."
Wie störanfällig ist das Analyseverfahren?
Der Kölner Pathologe Reinhard Büttner kann die Entscheidung hingegen nachvollziehen.
Büttner: "Ich gehe davon aus, dass es nicht unter den Tisch fällt, sondern dass man, sobald jetzt gute klinische Erfolge und Daten vorliegen, dass das auch im EBM integriert wird. Ich bin sehr sicher, dass auch die Blutanalytik in die breite Anwendung kommen wird.
Bis dahin werden aber wohl einige Jahre vergehen, denn es gibt noch einige offene Fragen rund um die Liquid Biopsy: etwa ob die Menge der ins Blut abgegebenen Tumor-DNA mit seiner Aggressivität zusammenhängt, wie störanfällig die hochsensitiven Mess- und Analyseverfahren sind und welche entdeckten Mutationen den Tumor tatsächlich wachsen lassen.
Dennoch könnten die Krankenkassen, wenn sie denn wollten, die Verbreitung der neuen Blutbiopsie erheblich vorantreiben. Sie könnten sie schon jetzt bezahlen. Und zwar im Rahmen von so genannten "Selektivverträgen", erklärt Ursula Marschall:
"Das ist eine Möglichkeit, die jede Krankenkasse hat, wo sie speziell für ihre Versicherten Leistungen vereinbaren kann, die außerhalb der Regelleistung sind."
Doch trotz des unbestritten großen Potentials zögern die allermeisten Krankenkassen. Eine Ausnahme ist die Barmer. Sie hat als erste Krankenversicherung bundesweit Selektivverträge mit zwei Netzwerken abgeschlossen, die mit der Flüssigbiopsie den genetischen Code von Lungentumoren bestimmen. Durch den Vertrag steht die Liquid Biopsy jetzt allen Lungenkrebspatienten, die bei der Barmer versichert sind, offen. Entscheidend für den Vertragsabschluss war auch, dass die Netzwerke das Transportproblem der Blutproben in den Griff bekommen haben, zum Beispiel durch die High-Tech Blutröhrchen, die die Tumor-DNA über Stunden und Tage konservieren. Denn das Blut soll reisen, nicht die Patienten, betont Ursula Marschall.
"Für uns ist es ganz wichtig, dass wir diese medizinische Kompetenz zentralisiert zusammen haben, die Behandlung aber wohnortnah stattfinden kann. Das heißt, es muss nicht jeder niedergelassene Onkologe, Lungenfacharzt, Lungenklinik sich mit diesem speziellen Thema beschäftigen. Es reicht, wenn er sich quasi die Voraussetzungen erklären lässt, dann kann er ganz normal die Blutprobe entnehmen. Und alles Weitere findet dann in dem spezialisierten Zentrum in Zusammenarbeit mit dem Pathologen statt."
Hier wird das Blut auf Resistenzen und Mutationen in der Krebs-DNA untersucht und das Ergebnis interdisziplinär ausgewertet. Heraus kommt ein Vorschlag an den behandelnden Arzt vor Ort, von welchem Medikament der Patient derzeit wahrscheinlich am meisten profitiert.
Nutzen muss beim Patienten liegen
Viele Krankenkassen scheuen wohl auch die Folgekosten der Liquid Biopsy, denn durch die neue Diagnostik verändert sich auch die Behandlung. Das ist ja das eigentliche Ziel der Blutbiopsie.
Marschall: "Wir sind uns der Chancen, aber natürlich auch der ökonomischen Risiken, sehr wohl bewusst. Wir wissen, dass aufgrund der neuen Mutationen, die wir jetzt kennen, eine neue Generation von Arzneimitteln auf dem Markt ist, beziehungsweise auf den Markt kommen wird. Das sind die so genannten Check-Point-Inhibitoren. Diese Check-Point-Inhibitoren werden in der Regel nicht als einzelne Substanz verabreicht, sondern in Kombination. Unsere ersten Erfahrungen sind, dass da durchaus bis zu 800.000 Euro pro Patient auf die Kassen zukommen können."
Das Stimmt, meint auch Michael Kazinski vom Biotechnologieunternehmen Qiagen. Aber das sei nur die halbe Wahrheit.
Kazinski: "Wie hoch sind die Kosten im Gesundheitswesen, die entstehen, weil ein Patient ein Chemotherapeutikum bekommt, was nicht wirksam ist? Und die daraus resultierenden Kosten sind erheblich. Das ist ein Punkt, der in der heutigen Diskussion noch nicht wirklich berücksichtigt wird. Durch die Flüssigbiopsien sind sie in der Lage, schneller und individueller auf den Verlauf der Erkrankung des Patienten zu reagieren. Und die klinischen Daten sind heute schon derart überzeugend, und ich glaube, dass hier Flüssigbiopsien für das Gesundheitssystem langfristig deutliche Vorteile haben werden."
Davon geht auch der Bochumer Darmkrebsspezialist Wolff Schmiegel aus. Um die Krankenkassen ebenfalls davon zu überzeugen, müsse allerdings sichergestellt sein, sagt er, dass die neue Blutanalyse nur dann eingesetzt wird, wenn sie tatsächlich dem Patienten nutzt – und nicht den Anwendern. Denn leider gebe es im Medizinbetrieb den Reflex, neue Technologien inflationär einzusetzen, sobald sie von den Versicherungen bezahlt würden. Das füllt dann schlimmstenfalls nur die Kassen der Pharmafirmen, Ärzte und Kliniken, ohne dass der Patient tatsächlich davon profitiert, kritisiert der Chefarzt.
Schmiegel: "Und wissen sie, das kann man lösen. Und zwar mit einem molekularen Tumorboard. Wir haben das Konzept der zertifizierten Zentren, Organkrebszentren, onkologische Zentren und dann die von der Deutschen Krebsgesellschaft ausgelobten Spitzenzentren. Alle haben eine zwingende Auflage: die Therapieentscheidung in einem interdisziplinären Tumorboard zu treffen, wo alle verschiedenen Disziplinen gehört werden können. Das kann man da auch machen. Da gehört es rein."
Hoffnung auf mehr Lebenszeit
Netzwerke, molekulare Tumorboards, in denen alle medizinischen Fachdisziplinen zusammenarbeiten, internationale Datenbanken, mehr Grundlagenforschung, um die Wirkung von erkannten Mutationen zu verstehen, und Studien, die den langfristigen Nutzen für die Patienten belegen – das sind also die nächsten Schritte, um die noch sehr junge Liquid Biopsy voranzutreiben. Dass die Flüssigbiopsie über kurz oder lang einen festen Platz in der Krebsbehandlung haben wird, ist aber jedem klar.
Für Isabell Hillbrand bedeutet die Liquid Biopsy schon jetzt Hoffnung auf mehr Lebenszeit. Mehr gute Lebenszeit für sich, für ihre beiden Kinder und ihren Partner. Die Flüssigbiopsie, sagt sie, sorge für spürbare Erleichterung. Nicht nur, weil ihr nicht mehr so häufig Gewebeproben entnommen werden müssen:
Hillebrandt: "Ja, ich bin jetzt 3,5 Jahre zu Gange und als ich die Diagnose bekam, hab ich nicht wirklich damit gerechnet, dass ich so lange … da hat man ja dann ganz andere Gedanken. Bei jedem verläuft das ja auch anders. Deswegen kann man da - und will ich da auch gar keine Zeitangaben wissen. Aber die Hoffnung ist natürlich auch nicht weg, dass doch noch mal was gefunden wird, was mich komplett heilt. Ja. Dass es jetzt so lange gut geht und vor allem, dass es mir jetzt so gut geht, ist natürlich schön. Gucken einfach, wie lange es noch gut geht. Und hoffen ganz lange."