Autorin und Sprecherin: Kathrin Baumhöfer
Regie: Friederike Wigger
Technik: Frank Klein
Redaktion: Martin Mair
Multiresistente Keime
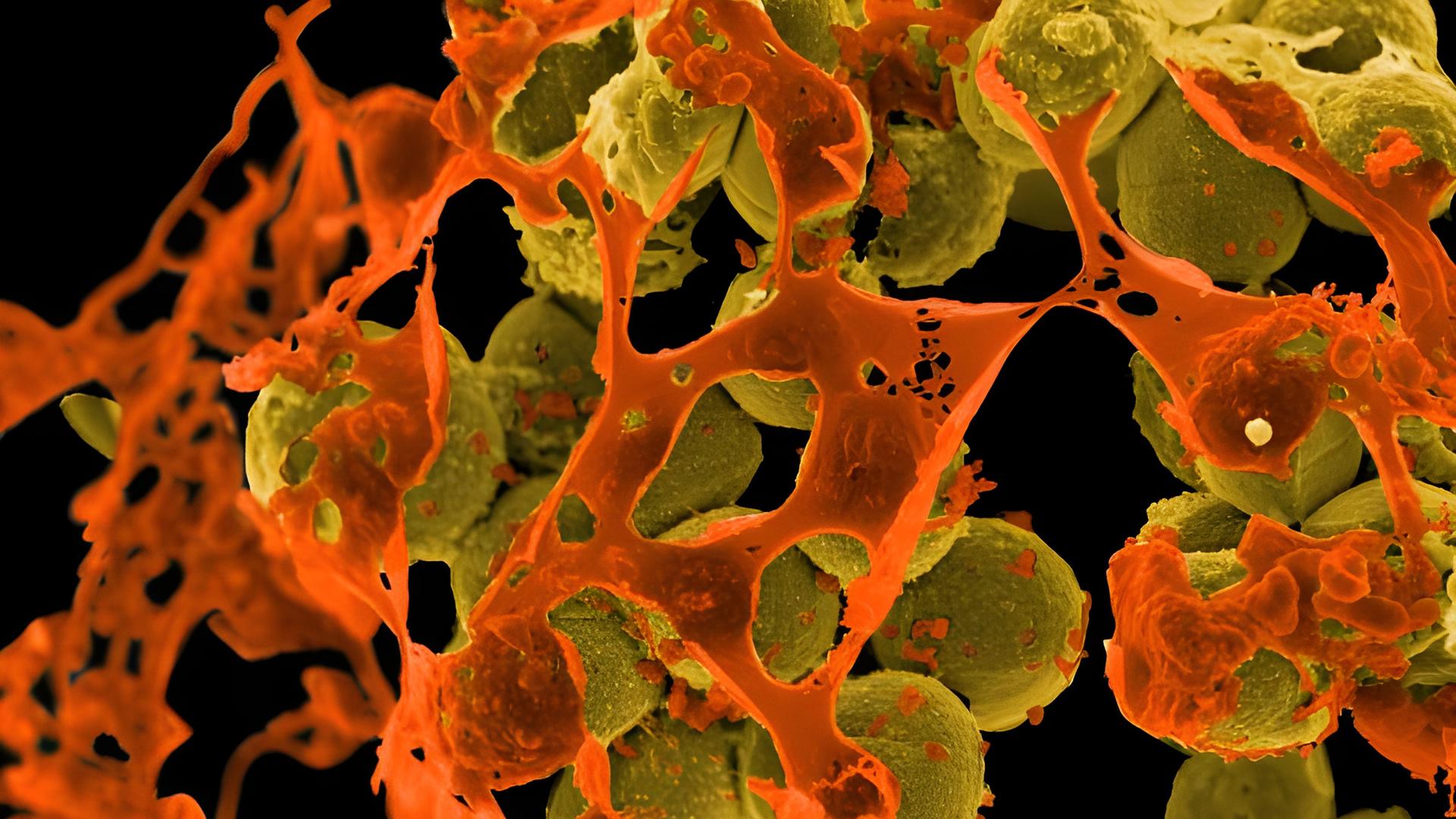
Multiresistente Keime wie Staphylococcus aureus sind für eine Vielzahl von Todesfällen ursächlich. © picture alliance / BSIP / image point / Niaid
Die stille Pandemie
30:18 Minuten

Jährlich sterben über 1,2 Millionen Menschen an einer Infektion mit resistenten Erregern. Die Zeit für neue Lösungen drängt, die Suche nach neuen Medikamenten gerät ins Stocken. Die großen Pharmafirmen sind aus der Antibiotikaforschung ausgestiegen.
"Wir stehen jetzt vor dem Schrank unserer Antibiotika. Hier sind die verschiedenen Schütten, in denen unsere Antibiotika vorgehalten werden“, zeigt Michael Gores. Er ist Oberarzt der Intensivstation des Evangelischen Krankenhauses Bergisch Gladbach. „Das heißt, die verschiedenen Substanzklassen wie Penicilline, Cephalosporine, Carbapeneme, Fluorchinolone, die einfach hier schon mal vorrätig sind und dann bei jedem – ich sag mal Erstangriff – direkt entnommen werden können."
Der Mediziner setzt täglich Antibiotika ein. Sie sind oft entscheidend für die Behandlung und die Überlebenschancen seiner Patienten. Michael Gores braucht sie, um bakterielle Infektionen zu bekämpfen. Meist gelingt das gut.
Eine Ausnahme sind Erreger, die sich gegen Antibiotika wehren können. Sie sind resistent – gilt dies für mehrere Antibiotika: multiresistent. Die üblichen Medikamente wirken dann nicht mehr. "Es gibt verschiedene Keime, die mit Resistenzen in Verbindung gebracht werden“, so Gores. Beispielsweise der E. coli. „Das fängt damit an, dass er auf das sogenannte Ampicillin Sulbactam, das Unacid, was wir gerne im Krankenhaus verwenden, mit über 40 Prozent resistent ist. Das ist zwar jetzt kein multiresistenter, aber da fangen die Resistenzen schon an.“ Bakterien wie Klebsiellen oder Pseudomonas würden da eine Rolle spielen. „Citrobacter, Morganella, Serratia sind verschiedene Bakteriengruppen, die auch Resistenzen entwickeln können."
Kampf gegen multiresistente Erreger
Seine Patienten auf der Intensivstation haben oft ein geschwächtes Immunsystem. Keime, mit denen ein gesunder Körper spielend fertig wird, können dann zum Problem werden. Das gilt insbesondere für multiresistente Erreger. Deren wohl bekanntester Vertreter: der auch gegen das Antibiotikum-Methicillin-resistente Staphylococcus aureus (MRSA). Viele Menschen tragen diese Bakterien auf der Haut, ohne dass sie Probleme machen. Anders bei Patienten, die bereits an einer schweren bakteriellen Infektion leiden. Bei ihnen zählt vor allem die Zeit.
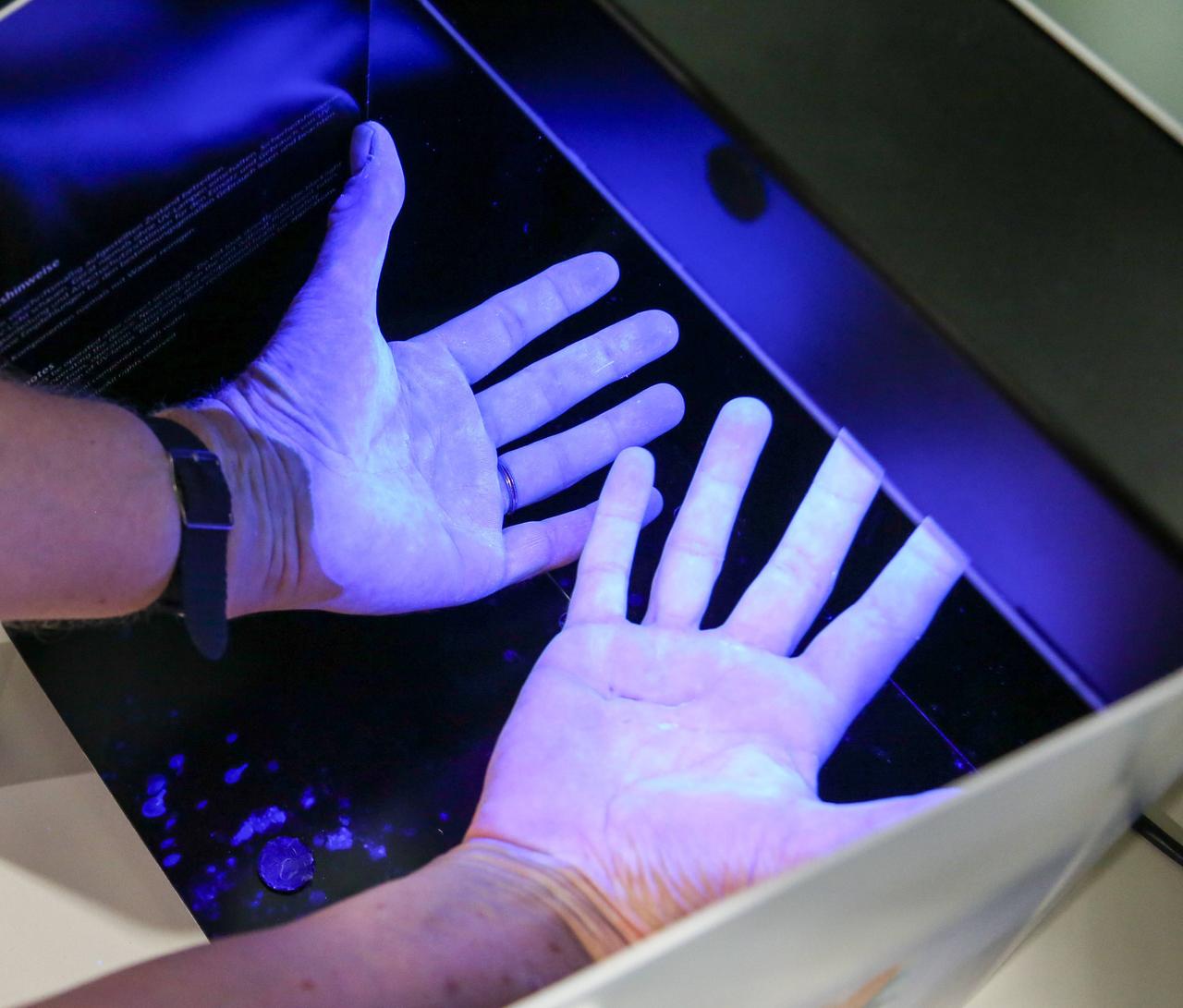
Krankenhaushygiene ist unabdingbar: UV-Licht macht Verschmutzungen an den Händen sichtbar.© imago / Joker / Jörg Loeffke
In solchen Fällen macht Michael Gores zweierlei: die Infektion möglichst schnell und breit bekämpfen und gleichzeitig herausfinden, mit welchem Keim er es zu tun hat. Im klinischen Alltag auf der Intensivstation heiße das: „Wir nehmen Blut beim Patienten ab – mindestens zwei, am besten drei Paare von Blutkulturen, die dann eingeschickt werden –, wir untersuchen den Urin und versuchen auch, Sekret aus der Lunge zu gewinnen, damit wir sagen können: Irgendwo dort liegt die Infektion. Ich weiß es noch nicht genau. Ich muss sie jetzt sofort behandeln, auch mit einem Breitspektrum-Antibiotikum, aber ich möchte wissen, wer mein Gegner ist.“ Das könne man nur mittels der Laboruntersuchungen herausfinden. „In der Regel bekomme ich in zwei bis drei Tagen die ersten Aussagen und kann dann die Antibiotikatherapie anpassen. Ich muss am Anfang sehr breit einsteigen. Das heißt, ich muss ein Antibiotikum wählen, das möglichst viele Keime erwischt, kann dann im zweiten Schritt reduzieren, also sogenannt deeskalieren und dann gezielt auf diesen Keim geben."
Im Fokus stehen vor allem multiresistente gramnegative Bakterien (MRGN). Für die Tests gibt es seit 2012 einheitliche Regeln. Michael Gores prüft, ob die Bakterien aus den Patientenproben gegen eine oder mehrere Substanzklassen von Antibiotika resistent sind. "Dann kann man ganz genau sagen: Wir haben einen Keim, zum Beispiel Enterobakterien, der nur noch auf Carbapeneme sensibel ist, sonst gegen alle anderen resistent ist. Das wäre dann zum Beispiel ein 3-MRGN, weil er drei Resistenzmuster hat.“ Wenn er gegen alle dieser Standardkriterien resistent sei, spreche man von 4-MRGN. Auch solche Infektionen können behandelt werden – allerdings ist die Luft hier spürbar dünner.
Der Patient wird isoliert, und es ist Zeit für Reserveantibiotika. Auch die stehen in dem schmalen, weißen Schrank auf der Intensivstation zwischen dem Arbeitsbereich mit Überwachungsmonitoren und den Patientenzimmern. "Reserveantibiotika sind Medikamente, die wir auch in dem alltäglichen Standard auf der Station bereithalten“, so Gores. Sie würden auch teilweise bei schwersten Infektionen eingesetzt. „Weil wir auch bei den Breitspektrum-Antibiotika Klassen haben, die nicht alles abdecken, sodass wir dort im ersten Schritt bei den schwersten Infektionen auch schon mit den Reserve-Antibiotika einsteigen müssen. Die sollen uns natürlich sagen: Das ist unsere Reserve, wenn nichts anderes mehr geht. Vorher bitte genau drüber nachdenken, welches Antibiotikum eingesetzt werden kann und welches niederschwellige Antibiotikum ich nehmen kann."
Dass Bakterien Resistenzen ausbilden, ist ein natürlicher Prozess. Bakterien teilen sich, um sich zu vermehren. Jedes Mal wird dabei die Erbinformation kopiert und auf die Tochterzellen verteilt. Bei diesem Kopiervorgang passieren Fehler. Einige bleiben folgenlos, andere sind so schwerwiegend, dass die Zelle stirbt.
Manchmal aber entstehen Mutationen, die der Zelle einen Vorteil verschaffen: zum Beispiel, wenn sie Moleküle ausschalten kann, die sie angreifen – wie etwa Antibiotika. Passiert all das, wenn Antibiotika präsent sind, überleben vor allem diejenigen Zellen, die sich gegen die Stoffe wehren können. Manchmal können Bakterienzellen die Erbinformation für solche Resistenzen auch von außen aufnehmen, ohne sich zu teilen.
Ein Wettlauf gegen die Zeit
Verhindern lassen sich Resistenzen nicht. Für die Entwicklung von neuen Antibiotika bedeutet das einen Wettlauf mit der Zeit. Das Ziel: Die Bakterien dort angreifen, wo sie – noch – verwundbar sind. Doch die Zeit wird knapp, sagt Rolf Müller, der die Entwicklung neuer Wirkstoffe ins Zentrum seiner Forschungen gestellt hat. Im Rahmen des Helmholtz-Zentrums für Infektionsforschung koordiniert er den Bereich „Neue Antibiotika“: "Es ist durchaus ein Prozess, der uns akut schon trifft“, betont er. „Es gibt Tausende von Toten jährlich, auch in Deutschland, wegen multiresistenten Keimen, die nicht mehr behandelbar sind mit Antibiotika."
Wie groß das Problem ist, zeigt eine Studie, die gerade in der Fachzeitschrift „The Lancet“ erschienen ist. Im Jahr 2019 starben dieser Schätzung zufolge weltweit mehr als 1,2 Millionen Menschen an einer Infektion mit multiresistenten Keimen. Bei weiteren fast fünf Millionen Menschen war eine solche Infektion mitverantwortlich für ihren Tod. Die Autoren hatten Daten aus der Fachliteratur analysiert, aber auch aus Krankenhaus-Datenbanken, Überwachungssystemen und anderen Quellen.
Die Analyse sei die bisher umfassendste, schreiben die Fachleute. Sie haben 204 Länder und Regionen, 23 krankmachende Bakterien und 88 Kombinationen von Bakterien und Antibiotika berücksichtigt. Das Problem ist also bekannt. Experten wie Rolf Müller sprechen von einer „stillen Pandemie“, die seit Jahrzehnten im Gang sei, aber lange nicht die Beachtung erfahren habe wie beispielsweise Covid. „Die Bedeutung für die Gesellschaft ist wahrscheinlich ähnlich. Die Problematik ist halt die, dass wir bei den Erkrankungen, die durch Mikroorganismen, durch Bakterien, hervorgerufen werden, in den meisten Fällen keine Impfungen haben und vermutlich auch nicht so bald kriegen werden. Das liegt jetzt weniger an den neuen Impfstoffen, sondern einfach daran, dass die Bakterien als Lebewesen deutlich komplexer sind als die eigentlich ja toten Viren."
WHO fordert Strategien gegen Superkeime
Im Februar 2017 veröffentlicht die WHO eine Liste mit zwölf Bakterienstämmen, die nach ihrer Einschätzung die größte Gefahr für die menschliche Gesundheit darstellen. Das Tableau unterscheidet drei Kategorien danach, wie dringend neue Antibiotika zu deren Behandlung gebraucht werden. Ganz oben steht Acinetobacter baumannii – ein Keim, der oft schon Resistenzen gegen Antibiotika der neuesten Generation entwickelt hat. Bei geschwächten Patienten – etwa auf Intensivstationen von Krankenhäusern oder in der Pflege – kann er tödliche Blutvergiftungen oder Lungenentzündungen verursachen.

Staphylococcus aureus ist ein Bakterium, das viele Menschen besiedelt, ohne Krankheiten hervorzurufen. In besonderen Fällen führt es jedoch zu Infektionen, die aufgrund der vorhandenen Antibiotikaresistenzen schwer zu behandeln sind.© imago / ZUMA Wire / David Brooks
Ebenfalls auf der Liste stehen MRSA oder Salmonellen. Auch die Politik hat das Problem erkannt: Bereits 2015 verpflichten sich alle Mitgliedsstaaten der WHO, eigene nationale Strategien für die Bekämpfung multiresistenter Keime zu entwickeln. Ein Jahr später wird dieser globale Aktionsplan von der Generalversammlung der Vereinten Nationen bestätigt.
Beim G20-Gipfel 2017 in Hamburg sind Antibiotikaresistenzen eines der Kernthemen. Und die Coronapandemie bringt 2021 das Thema auf die Agenda des Treffens der Finanzminister der G7-Staaten. Im Abschlussdokument heißt es:
„Covid-19 hat gezeigt, wie wichtig es ist, die Bereitschaft zu stärken, um globalen Gesundheitsbedrohungen zu begegnen, einschließlich der ‚stillen Pandemie‘ der Antibiotikaresistenz. Trotz dieser Bedrohung tragen verschiedene Faktoren, darunter Marktversagen, dazu bei, dass keine neuen Antibiotika entwickelt werden und seit mehr als drei Jahrzehnten keine neue Antibiotikaklasse auf den Markt gekommen ist.“
Antibiotika bringen Pharmafirmen kein Geld ein
Wie aber kann das sein? Woher kommt der Mangel? Warum tun wir uns so schwer damit, neue Antibiotika zu entwickeln? Und wer treibt diese Forschung und Entwicklung voran?
Auf der Suche nach Antworten sucht man die Namen großer Pharmaunternehmen vergeblich. So sind etwa Bayer, Bristol-Myers Squibb, Abbott und Eli Lilly schon vor mehr als zehn Jahren aus der Antibiotikaforschung ausgestiegen. Astra Zeneca, Novartis, und Johnson & Johnson folgten. "Eine Therapie mit Antibiotika wird relativ geringfügig erstattet“, erklärt Rolf Müller. „Da reden wir in der Regel von wenigen hundert Euro maximal pro Patient.“ Bei andere Therapien würden durchaus sechsstellige Summe pro Patient vom Gesundheitssystem getragen werden. „Solange das so ist, ist es schwierig, pharmazeutische Unternehmen davon zu überzeugen, in diesem Bereich zu investieren."
Es lohnt sich also nicht: zum einen, weil sich mit Präparaten für chronisch Kranke ungleich mehr Geld verdienen lässt. Sie werden über einen langen Zeitraum eingenommen. Zum anderen sind neue Antibiotika so wertvoll, dass sie oft als Reserveantibiotika eingestuft und deshalb möglichst selten eingesetzt werden. Geld verdienen lässt sich so also auch nicht.

1928 entdeckte Alexander Fleming den Grundstock für das Antibiotikum Penicillin. Schon damals warnte er vor inflationärem Gebrauch und Resistenzen. © imago / ZUMA / Keystone
Darüber hinaus ist die Entwicklung neuer Präparate aus gleich mehreren Gründen riskant. Einerseits entwickeln sich neue Resistenzen sehr schnell – manchmal schon, bevor die Medikamente auf den Markt kommen. Andererseits sind da noch die Risiken der Forschung selbst. "Die Entwicklungskosten für ein Produkt bewegen sich im 100-Millionen- bis Ein-Milliardenbereich. Da sind die Produkte, die es nicht geschafft haben, noch nicht mit einberechnet“, sagt Andreas Vente. „Für eine neue Klasse ist die Wahrscheinlichkeit, dass das Produkt zum Markt kommt, fünf Prozent. Das heißt, man muss 20 haben, damit man eins hat, das durchkommt, rein statistisch.“ Der Biologe hat diese Risiken als Mitgründer der Firma Merlion Pharmaceuticals selbst erlebt.
Keine neuen Antibiotika auf dem Markt
Vom Molekül, das man findet, bis zum fertigen Produkt dauere es zehn bis 15 Jahre. „Wenn wir jetzt feststellen, dass heute hier in der Pipeline ganz wenig ist, dann zeigt das: „Was kommt in den nächsten zehn bis 15 Jahren neu auf den Markt. Da wird fast nichts dabei sein, was wirklich grundsätzlich neu ist, nach meiner Einschätzung. Selbst, wenn wir einige Moleküle haben, die ganz grundsätzlich neu sind, darf man nicht vergessen, dass für diese Klassen die Wahrscheinlichkeit, dass sie zum Produkt führen, im niedrigen einstelligen Prozentbereich liegt." Vor allem das hohe Entwicklungsrisiko und finanzielle Priorisierungen haben die großen Pharmaunternehmen zum Ausstieg aus der Antibiotikaforschung veranlasst.
Um überhaupt neue Mittel auf den Markt zu bringen, müssen also andere Wege gefunden werden. Und das erhöht den Druck auf die akademische Forschung, sagt der Helmholtz-Wissenschaftler Rolf Müller. Doch „wie wir derzeit aufgestellt sind, kann die Academia alleine es auch nicht leisten.“ Die Industrie habe keinen Schwerpunkt in der Entwicklung neuer Antibiotika. „Das ist ja ganz klar, und wenn man jetzt gesellschaftspolitisch denkt, oder gesundheitspolitisch, dann muss ja die Maßgabe sein, irgendwie brauchen wir in fünf Jahren und in zehn Jahren neue Antibiotika, sonst können wir die multiresistenten Keime nicht mehr bekämpfen.“
Man differenziert zwischen einer völlig neuen Klasse von Antibiotika und solchen, die bestehende Klassen lediglich weiterentwickeln. Bei Letzteren wird zum Beispiel die Molekülstruktur so verändert, dass sie gegen zusätzliche Bakterienarten wirksam sind. Oder so, dass sie befallenes Gewebe besser erreichen.
Notwendig geworden sind diese weiterentwickelten Antibiotika wegen der entstandenen Resistenzen, erklärt Andreas Vente: "Dementsprechend muss man mit dieser Entwicklung Schritt halten, damit man genau so effektiv diese Bakterien noch bekämpfen kann, wie das vielleicht vor 30, 40 Jahren mal der Fall war, als man zum ersten Mal mit einer bestimmten Klasse von Antibiotika gegen diese Keime vorgegangen ist.“ Dementsprechend gebe es immer wieder neue Entwicklungen, auch in bestimmten Substanzklassen. „Dann spricht man von erster, zweiter, dritter oder vierter Generation."
Von diesen Antibiotika kommen durchaus Präparate auf den Markt. Nur: Das grundsätzliche Problem der Resistenzen lösen diese Mittel nicht, sagt Pharmazeut Rolf Müller. "Das sind aber solche, die wir meist als Me-toos bezeichnen, die aus Altantibiotika hervorgehen, keinen neuen Wirkmechanismus haben, keine neue Struktur haben, und so halt relativ schnell wieder von den alten Resistenzmechanismen betroffen sein werden."
Forschung mit öffentlichen Fördermitteln
Die Entwicklung neuer Antibiotika gliedert sich in mehrere Phasen. Bei der Suche nach Molekülen und einer chemischen Optimierung der interessantesten Kandidaten vergehen bis zu sieben Jahre. Die Zahl der Moleküle reduziert sich in dieser Zeit meist von einigen tausend auf vielleicht zehn – etwa, weil man lediglich alte Bekannte wiederfindet. Oder weil sich herausstellt, dass die Substanzen nicht nur für Krankheitserreger giftig sind, sondern auch für menschliche Zellen.
Für die Industrie ist dieser erste Schritt wenig lukrativ. Deshalb springt hier die öffentliche Hand ein. "Das ist praktisch alles öffentlich gefördert“, so Müller. „Das sind Institutionen, deren Widmung eben im Bereich der Infektionsforschung ist, die öffentliche Fördermittel dafür verwenden, diese Projekte durchzuführen. Es gibt dafür EU-Fördergelder, es gibt einige Funder wie die Gates Foundation oder den Wellcome Trust, die dort auch Mittel ausloben, um in diesem Bereich tätig zu sein."

Unternehmen wie Astra Zeneca haben sich aus der Antibiotika-Forschung zurückgezogen.© picture alliance / Goldmann
In Deutschland beteiligt sich das Forschungsministerium an nationalen Fördermaßnahmen und internationalen Initiativen mit durchschnittlich 50 Millionen Euro pro Jahr – die aber nach Auskunft des Ministeriums in den vergangenen fünf Jahren zu weniger als der Hälfte abgerufen wurden. Einen Grund hierfür sieht Rolf Müller in den großen Risiken der Forschung. Das meiste funktioniere halt nicht bis zur Markteinführung. Deshalb sei die Zurückhaltung sehr groß. „Wenn man jetzt nochmal zurückgeht an die durchschnittlichen Kosten bis zur Markteinführung, da sind dann halt auch öffentliche Förderer einfach überfordert in ihren finanziellen Möglichkeiten. Auch ein Bundesministerium kann ja jetzt nicht mal eben so eine Milliarde zur Verfügung stellen und sagen, macht da jetzt mal was mit."
Wirkstoffentwicklung kann Investoren locken
Die nächste Phase der Wirkstoffentwicklung kann zum ersten Mal privatwirtschaftliche Investoren auf den Plan rufen. Jetzt geht es darum, wie und wie stark ein Stoff wirkt und wie der Körper auf die Substanz reagiert.
Wir befinden uns noch immer im Labor. Jetzt sind noch etwa fünf bis zehn Kandidaten-Moleküle im Rennen. Es ist die Phase der Tierversuche. Was sich hier als wirksam und sicher erweist, kann in klinischen Studien für eine Anwendung am Menschen erprobt werden. Die meisten der internationalen Initiativen richten sich auf diese sogenannte präklinische Phase. Das Ziel: eine Zusammenarbeit zwischen Forschung und Pharmafirmen. Gar nicht so einfach, meint Rolf Müller und verweist auf eine grundsätzlich andere Ausrichtung der beiden potenziellen Partner.
Für die akademische Forschung sei es wichtig, "dass die erlangten Ergebnisse dann auch publiziert und der Allgemeinheit zur Verfügung gestellt werden“. Das wiederum stehe in gewissem Widerspruch zu den Interessen der Firmen, die bei interessanten Entwicklungen natürlich davon profitieren, dass solche Daten nicht zugänglich sind und proprietär, also durch Patente, abgesichert sind. „An dieser Stelle, da müssen wir sicher noch viel arbeiten, um die Interessen der Industrie mit den Interessen der akademischen Arbeit zusammenzubringen."
Wenige Erfolgsgeschichten
Dennoch gibt es Erfolgsgeschichten. Die Ideen aus der akademischen Forschung bilden die Basis für eine Geschäftsidee, die private Geldgeber anlockt. Start-ups entstehen – auch im Bereich der Antibiotika-Entwicklung.
Andreas Vente ist den Weg eines Start-ups gegangen. Der Biologe hat mehrere Jahre in der akademischen Welt geforscht, ehe er im Jahr 2000 Merlion Pharmaceuticals mitbegründet hat. Das Ziel der Firma: neue Antibiotika entwickeln. "Wir haben als kleines Unternehmen da ein in den USA zugelassenes Produkt mit dem Wirkstoff, den wir selber entwickeln.“ Es geht um u Ohrentropfen, die vor allem bei Kindern Infektionen im Gehörgang behandeln.
Die Entwicklung war teuer: Nach einer Anschubfinanzierung griffen die Firmengründer auf Unternehmensbeteiligungen zurück. "Wir haben Glück, dass wir treue und wirklich interessierte Risikokapitalgeber gefunden haben“, sagt Vente. „Wir haben einen strategischen Investor an Bord. Wir haben im Lauf der Entwicklung die Zusammenarbeit mit Forschungsstellen staatlicher Seite gehabt, die vieles finanziert haben. Und wir hatten einen Lizenzpartner, ein US-Unternehmen, das später von Novartis übernommen wurde, was die Ohrentropfenentwicklung klinisch vorangetrieben hat. Wir haben parallel dazu die Produktion vorangetrieben. Das war eine gemeinsame Entwicklung letztendlich. Das hat zur Zulassung des Produkts in den USA geführt."
Darin enthalten war die letzte und teuerste Phase der Weiterentwicklung zum Medikament, die Studien an Menschen. Dauer: noch einmal ein bis zwei Jahre. Kosten: oft mehrere hundert Millionen Euro. Spätestens das lässt sich nur mit großen Partnern aus der Industrie stemmen. Schon allein wegen der Produktion.
"In der Tat muss die Produktion vom Gramm-Maßstab bis auf den Tonnen-Maßstab hochgefahren werden“, so Vente. Parallel zu der klinischen Entwicklung – und die berge natürlich auch Risiken. „Am Anfang ist das natürlich sehr teuer, wenn man es nur in so kleinem Maßstab herstellt. Auch das ist für ein kleines Unternehmen ein Risiko. Genauso fehlt komplett in der Regel ein Überblick: Wie kommuniziere ich mit Behörden, wie ist der regulatorische Ablauf. Auch das muss erlernt werden." Und dann gibt es da noch Unterschiede bei der Zulassung, die in Europa durch die Europäische Kommission erfolgt. Grundlage dafür ist eine Empfehlung der Europäischen Arzneimittelbehörde (EMA).
USA bietet einen größeren Markt
Am Ende aber spiele die Musik in den USA, sagt Vente. „Die Preise, die man da erzielen kann, sind höher als anderswo. Der Markt ist einheitlich. In Europa haben wir zwar die EMA, aber wir haben für jedes Land noch eine Unterbehörde, die im Prinzip auch eigene Entscheidungen treffen kann. Das birgt Risiken.“ In den USA gebe es dagegen einen Markt entsprechend großen Markt. „Die Amerikaner sind etwas weiter, was diese Finanzierungsoptionen und Möglichkeiten angeht, und auch die Incentivierung, diese Entwicklung anzustoßen. Aber selbst das hat noch nicht dazu geführt, dass wir viele große Pharmafirmen wieder mit ins Boot geholt haben, um sich da zu engagieren."
Das Fehlen der großen Firmen bleibt also auf jeder Stufe spürbar. Um die Entwicklung neuer Antibiotika dennoch voranzutreiben, sind mehrere Szenarien denkbar: Große Pharmakonzerne könnten verpflichtet werden, einen Teil ihrer Gewinne abzugeben, der dann in die Forschung für neue Präparate fließt.
Man könnte Prämien an Unternehmen zahlen, die ein neues Antibiotikum auf den Markt bringen – finanziert etwa durch den Staat oder von den Krankenkassen, zum Beispiel durch höhere Preise für Antibiotika. Entsprechende Modelle gibt es bereits, sagt der Helmholtz-Wissenschaftler Rolf Müller. In England und Schweden sei dies vorletztes Jahr eingeführt worden. „Das ist noch zu früh, um da sagen zu können, ob das jetzt großartige Erfolge mit sich bringt. Ist auch problematisch, wenn so etwas einzelne Länder machen, weil die großen Pharmahersteller natürlich international operieren, und nicht auf eine Markteinführung in einem, wenn auch wirtschaftlich starken Land dann hinarbeiten."
Neuartige Technologie
Markus Matuschka geht einen anderen Weg. Auch seine Firma Lysando sucht nach Möglichkeiten, Antibiotikaresistenzen zu bekämpfen – der Ansatz unterscheidet sich allerdings grundsätzlich von den bisher genannten. „Mein Beruf ist Unternehmer“, sagt er, „und was mache ich als Unternehmer? Ich suche disruptive Technologien. Wirklich neuartig. So, wie digitale Fotografie zur analogen. Da gibt es verschiedene Indikatoren, auf die sie achten können, zum Beispiel die Anmeldung der Patente. Das nennt man einen Infliktionspunkt. Das heißt, die Anmeldung der Patente nimmt deutlich ab.“ Das sei ein Zeichen dafür, dass sich etwas wirklich Neues anbahnt. „Aber Sie wissen natürlich nicht, was das Neue ist. Sie sehen nur, dass eine Technologie langsam an ihr Ende kommt, es läuft langsam aus."
Die Firma investierte in eine neuartige Technologie. Deren Grundlage: Moleküle, sogenannte Lysine, die von speziellen Viren produziert werden. Diese Viren heißen Phagen und befallen ausschließlich Bakterien. Ihre Designmoleküle nennt die Firma Artilysine, erklärt die leitende Mikrobiologin Anneleen Cornelissen. "Die Artilysine, die wir entwickeln, sind Moleküle, die von Bakteriophagen abgeleitet sind. Die Phagen produzieren sie, um sich am Ende ihres Replikationszyklus aus den Zellen zu befreien, die sie befallen haben. Dafür müssen sie die Bakterienzellen töten. Die Bausteine der Moleküle, mit denen sie das tun, entwickeln wir hier bei Lysando weiter, um Bakterien von außen zu bekämpfen. Wir modifizieren diese Molekül-Bausteine, um ihre Effizienz zur Abtötung der Bakterienzellen zu steigern.“
Geringes Risiko der Resistenz
Ein Ansatz, der grundsätzlich einen anderen Weg geht als Antibiotika, weil er nicht in den Stoffwechsel der krank machenden Bakterien eingreift. Lysine zerstören die Zellwand der Bakterien von außen.
"Die Artilysine docken aufgrund des Ladungsunterschiedes an“, erläutert Matuschka. „Die Artilysine sind positiv geladen, die Bakterien an der Oberfläche negativ.“ Von Spezies zu Spezies unterscheide sich das. „Darauf können wir uns individuell einrichten, wie wir die Artilysine programmieren, beziehungsweise konstruieren. Das ist spezifisch. Wir können tatsächlich an mehreren Schrauben drehen, um die Spezifizität sehr eng zu halten – oder auch breiter zu gehen.“ Und es gebe weitere Vorteile der Lysine, sagt Markus Matuschka: etwa, dass sie das Immunsystem nicht in Aufruhr bringen und die „guten“ Bakterien verschonen, die die Schleimhäute besiedeln.
Vor allem aber: Das Risiko von Resistenzen sei gering. "Antibiotika sind natürlich. Auch Bakterien stellen Antibiotika im Kampf gegen andere Bakterien her. Bis heute hat man noch kein natürliches Artilysin entdecken können. Es steht also zu vermuten, dass es auch keine Erbinformation in den Bakterien gibt, wie man sich gegen Artilysin wehren kann. Und das ist ein weiterer Grund dafür, warum wir diese sehr hohe Resistenzstabilität sehen."
Kritiker sind weniger euphorisch: Schließlich handelt es sich um körperfremde Eiweiße. "In einer Blutstrominfektion werden Sie vermutlich keine Enzyme, keine Lysine einsetzen können“, sagt der Helmholtz-Wissenschaftler Rolf Müller. „Der Körper reagiert wie auf einen Fremdstoff. Letztlich ist das wie eine Impfung: Sie bilden dann Antikörper gegen diese Proteine und machen sie selber unschädlich." Das schränkt eine Anwendung ein auf Stellen, die von außen erreichbar sind: Hautwunden etwa, oder auch die Lunge, wenn Lysine per Aerosol eingeatmet werden können.
Die Firma Lysando treibt die Entwicklung der Lysine in eigenen Laboren voran. Eine systemische Anwendung von Lysinen – also in der Blutbahn – schließt sie keineswegs aus. "Hier haben wir eine Kollegin, die gerade mit Blut arbeitet“, zeigt die Leiterin der Forschungsabteilung, Kerstin Emmrich. „Der Sinn der Sache ist, dass wir natürlich so früh wie möglich in der Entwicklung unserer Artilysine sicherstellen, dass sie ihre Wirkkraft auch in einer Umgebung entfalten können, in der sie am Ende geplant sind.“ Schließlich mache es ja keinen Sinn, Medikamente – oder überhaupt Wirkstoffe – zu entwickeln, die nur im Puffer im Reagenzglas funktionieren, „und das ist etwas, was wir im Moment implementieren".
Kaum Fördergelder, viele Lizenznehmer
Auch bei der Finanzierung ihrer Projekte geht die Firma einen anderen Weg. Auf Fördergelder greift sie kaum zurück, erklärt Markus Matuschka. „Ab und zu machen wir das auch. Das ist aber ganz sicher ein winziger Teil dessen, was wir tun. Warum? Der Aufwand steht für uns nicht dringend im Verhältnis zu dem Nutzen, und manchmal sind die Auflagen und die Papiere, die Sie ausfüllen müssen, so absurd. Für uns lohnt es sich mehr, nach Lizenznehmern zu suchen und in der wirklichen Wirtschaft unterwegs zu sein, im echten Wirtschaftsleben. Wir arbeiten ja nicht für irgendwelche Publikationen, sondern wir arbeiten dafür, den Menschen ernsthaft helfen zu können."
Die Firma hat nach eigenen Angaben seit ihrer Gründung 2009 bislang 14 Lizenzen vergeben – zuletzt an eine Tochter des Bayer-Konzerns. Eine finanzielle Unabhängigkeit, die sich in der Arbeitsweise und in den Ansprüchen ans Team spiegelt – und Probleme zwischen akademischer Forschung und Wirtschaft schafft. „Wenn Sie so stringent und so – austrainiert, will ich sagen – arbeiten, dann ist es nicht ganz so einfach, eine Kompatibilität zu einem öffentlichen Betrieb wie einer Universität herzustellen. Da sind die Schnittstellen nicht unbedingt miteinander zu verknüpfen."
Der Unternehmenschef beklagt noch einen Punkt: den Zulassungsprozess für neue Medikamente. Innovationen in Europa würden häufig als etwas Negatives empfunden. Lysando hat deshalb Partner in Südkorea gesucht. Dort herrsche eine ganz andere Mentalität. „Da geht man hin und sagt: Sagt mal, wir haben hier ein ernstes Problem – habt Ihr eine Lösung? Wie geht das? Und wissen Sie, was hier passiert? Hier ist es so, dass Sie, wenn Sie mit Artilysinen kommen, dann kommt die Regulierungsbehörde mit Tests – die für Antibiotika sind. Das ist so ähnlich, als wenn ich eine Luftfahrtbehörde habe, die Fessel-Luftballons zulässt, und ich komme mit dem Düsenjäger. Dann sagen sie: Ja, aber wie ist jetzt das Heißluftvolumen von Ihrem Düsenjäger? Und ich versuche denen zu erklären, dass er keins hat, weil, es ist ja kein Luftballon."
Im Wettstreit mit Einzellern
Was also muss passieren, damit die Forschung und Entwicklung neuer Antibiotika wieder in Schwung kommt? Bei dieser Frage sind die Beteiligten inhaltlich nicht weit voneinander entfernt. "Das ist sicher ein gesellschaftspolitisches Problem“, meint der Wissenschaftler Rolf Müller. „Eine Problematik, die auch daran liegt, dass wir Antibiotika gegenüber geringe Wertschätzung sehen."
Unternehmer Markus Matuschka wünscht sich „mehr Freude daran, was der Mensch alles an Gutem leisten kann. Dass wir wieder dahin kommen, dass man Wissenschaftler in Deutschland, die so Außergewöhnliches leisten wie hier die Mitarbeiter, anerkennt dafür. Und einfach mal mit Freude und Optimismus von Amts wegen sich das anschaut und sagt: Das ist ja toll, was Sie da hinkriegen, das ist ja super, und wir wollen Ihnen gerne dabei helfen, dass das was wird.“
Und Firmengründer und Biologe Andreas Vente? Er betont den persönlichen Antrieb für Forschende, sich dem Kampf gegen Keime zu stellen. "Man tritt in den Wettstreit mit Einzellern, die sich auf primitive Art und Weise verteidigen, und wir sind nicht in der Lage, die einfach wegzuwischen, sondern wir müssen wirklich unseren Kopf und alles, was wir haben, anstrengen, um das zu erreichen. Das finde ich persönlich äußerst herausfordernd und faszinierend. Das ist ein Thema, das wird mich wahrscheinlich mein Leben lang begleiten. Ich hoffe, es geht vielen Kollegen so, weil: Das werden wir brauchen, um den Krieg zu gewinnen. Gewinnen werden wir ihn wahrscheinlich nie – aber um mehr Oberwasser zu bekommen, als wir das im Moment haben."