Phase I: Erkaufte wissenschaftliche Erkenntnisse?
Klinische Studien mit Risiken und Nebenwirkungen
30:37 Minuten

Erforschung und Entwicklung neuer Arzneimittel liegt hierzulande in der Hand der Pharmaindustrie. Welche Risiken bergen die Studien für Patienten? Kritiker werfen der Branche zudem vor, sie produziere kaum neue Medizin mit echtem Zusatznutzen.
"Ich hatte eigentlich keine andere Option mehr und dann greifst du vielleicht nach jedem Strohhalm, den man hat", sagt Iris Klar. "Ich kann ja auch zu jeder Zeit die Studie abbrechen. Aber dann weiß ich auch nicht, was ich mache."
"Klinische Studien sind erforderlich", sagt Frank Wagner. "Es dürfen nur Medikamente auf den Markt gebracht werden, die umfänglich vorher untersucht wurden. Nach wissenschaftlich harten Kriterien."
"Ein Pharmakonzern ist ein Wirtschaftsunternehmen", sagt Ute Simon. "Also da, wo wir hinten keine Gewinne erzielen, können wir vorne nicht forschen."
"Ich bin mit dem Wort Skandal ziemlich sparsam", sagt Gerd Antes. "Aber das ist eigentlich ein chronischer Skandal: Dass circa 50 Prozent von den Studien, die begonnen wurden, nie dorthin kommen, wo sie hingehören: nämlich an die Öffentlichkeit."
Die Geschichte einer klinischen Studie beginnt in Zimmer 04 097. Auf der Station der Charité Research Organisation teilen sich zwei Frauen, beide 36 Jahre alt und gesund, den schmucklosen Raum. An den Schränken kleben Familienbilder, auf dem Nachttisch liegen vier Mandarinen in denen kleine Kerzen stecken – ein improvisierter Adventskranz. Die Probandinnen haben sich im Internet für die Studienteilnahme beworben.
"Und dann haben sie mich angerufen und gesagt", erzählt die eine der beiden, "ich könnte da zweimal zwölf Tage ein Zimmer haben. Da dachte ich, und es ist aber praktisch so, jetzt, genau in dem Moment."
Die Frauen nehmen an der ersten von insgesamt vier klinischen Phasen teil, die ein neues Medikament bis zur Zulassung durchlaufen muss. Sie testen eine neue Version eines Mittels zur Schwangerschaftsverhütung.
Zum ersten Mal wird an Menschen ausprobiert
"Also wir testen ein hormonelles Verhütungspflaster", erklärt die andere der beiden, "das im Prinzip so funktioniert wie die Pille. Nur dass wir es nicht oral zu uns nehmen, sondern es auf unseren Hintern geklebt wird."
In Phase I einer klinischen Studie wird ein Medikament zum ersten Mal an Menschen ausprobiert. Die Teilnehmerzahl ist in diesem Stadium klein, bis zu 100 Personen. Es geht darum, herauszufinden, wie verträglich ein neuer Wirkstoff ist und wie er im menschlichen Körper wirkt. Zuvor ist die Substanz an Zellkulturen und Tieren getestet worden.
"Die Pille nehmen wir auch fast alle, oder haben sie zumindest schon mal genommen", sagt eine der Probandinnen. "Deshalb dachte ich, dieses Hormon ist jetzt nicht so gefährlich. Habe ich für mich eingeschätzt."
Um das Risiko für die Versuchsteilnehmer möglichst gering zu halten, werden sie engmaschig überwacht. Die beiden Frauen dürfen die Station nicht verlassen und nur das vorgegebene Essen zu sich nehmen.
"Ja, wir haben das Pflaster sieben Tage drauf", erklärt die andere Probandin. "Dann haben wir täglich eine Blutabnahme, um zu schauen, wie viel von dem Hormon auch tatsächlich im System ankommt."
Doch, wenn nicht klar ist, was genau das Testmittel im Körper wirkt, wie er darauf reagiert und welchen Schaden es möglicherweise anrichtet: Warum setzen sich gesunde Menschen diesem Risiko aus? Warum werden sie freiwillig zu Versuchskaninchen?
"Die finanzielle Motivation, die ist schon reichlich bei der Studie, wo auch das Risiko recht gering ist", so die Probandin.
Ein Schiffsarzt begründete das Prinzip derartiger Studien
Die erste kontrollierte klinische Interventionsstudie geht auf den schottischen Schiffsarzt James Lind zurück. Ende des 18. Jahrhunderts fallen Tausende Matrosen Skorbut – also Vitamin-C-Mangel zum Opfer. Lind wagt ein Experiment mit zwölf erkrankten Matrosen. Er teilt die Seemänner in Zweiergruppen ein.

Der Schiffsarzt James Lind fand per Experiment eine Behandlung von Skorbut.© Getty Images / Bettmann
Alle sind in einem ähnlichen Stadium der Krankheit, alle werden unter etwa gleichen Bedingungen behandelt. Mit einem Unterschied: Jede Gruppe bekommt einen anderen Nahrungszusatz: Essig, Apfelwein, Meereswasser, Abführmittel, Schwefelsäure oder Orangen und Zitronen. Das Ergebnis: Die Behandlung mit Zitrusfrüchten rettet die Seeleute.
James Lind hat damit das Grundprinzip für klinische Studien begründet: Sie müssen an vergleichbaren Personengruppen unter vergleichbaren Bedingungen ablaufen – nur so können Forscher belastbare Ergebnisse bekommen. Anders als für die Matrosen im 18. Jahrhundert ist für heute Teilnehmer der Medikamentenversuch ein lohnendes Geschäft: Jede Untersuchung, jede Blutentnahme, jeder Tag auf der Station wird nach einem festen Satz entlohnt.
Die Probandinnen können jederzeit aussteigen. Geld bekommen sie, entsprechend der erbrachten Leistungen, trotzdem. Für die zwei Frauen bedeutet das am Ende: 6000 Euro. Und das, so glauben sie, bei geringem Risiko. "Weil der Wirkstoff einfach auf dem Markt ist und es bei uns um den Kleber geht," sagt die eine der beiden.
Tödliches Negativbeispiel aus Frankreich
Dass das nicht immer so ungefährlich ist, beweist ein Fall aus Frankreich. Im Juli 2015 lief die erste Phase an einer Substanz an, die direkt im Gehirn wirkt. Sie sollte gegen unterschiedliche Erkrankungen eingesetzt werden: Angststörungen, Schmerzen, Parkinson, Bluthochdruck und Übergewicht.
Der Start verlief problemlos. Mehr als 90 Personen vertrugen eine Einmaldosis des Mittels gut, doch dann kam der 7. Januar 2016.
Jetzt schluckten die ersten Versuchspersonen das Mittel an mehreren Tagen hintereinander in hoher Dosierung. Zweieinhalb mal höher als in der Gruppe zuvor. Nach drei Tagen klagt der erste Proband über Kopfschmerzen, Seh- und Gleichgewichtsstörungen und wird in eine Klinik eingeliefert. Nach einer Woche stirbt er. Fünf weitere Probanden erleiden Hirnblutungen und müssen mit dauerhaften Schäden leben.
Der Aufschrei war groß, die Kritik richtete sich an alle Beteiligten. Die Testfirma habe fahrlässig gehandelt und die Umsetzung riskant geplant. Die Tierversuche seien zu lückenhaft gewesen. Den Zulassungsbehörden warf man vor, nicht auf Warnsignale gehört zu haben. Bis heute ist offen, wie genau es zu dem Zwischenfall kommen konnte. Klar ist: Beim ersten Test eines neuen Wirkstoffs am Menschen bleibt ein Risiko.
"Klinische Studien sind erforderlich"
"Es ist ein außerordentlich regulierter Bereich. Gerade bei frühen klinischen Studien ist das ein kritisches Umfeld, um Risiken zu minimieren. Es geht tatsächlich immer darum ein Risikomanagement für solche Studien zu machen. Und wenn alle Voraussetzungen gegeben sind, dann und erst dann wird eine Studie durchgeführt", sagt Frank Wagner. Er ist Geschäftsführer der Charité Research Organisation.
"Ein Problem ist das Wissen zum Teil über die klinischen Studien", erläutert er. "Klinische Studien sind erforderlich. Es dürfen nur Medikamente auf den Markt gebracht werden, die umfänglich vorher untersucht wurden. Nach wissenschaftlich harten Kriterien. Und das geschieht über die Phasen der Arzneimittelentwicklung und wir sind Teil dieser Wertschöpfungskette in den frühen Phasen und das ist eine wichtige Funktion."
Wagners Motivation ist der medizinische Fortschritt. Phase I Studien sind nötig, um neue Medikamente zu entwickeln. Die gesunden Teilnehmer lockt das Geld. Doch Gefahren für die Gesundheit lassen sich nie ganz ausschließen. Ein zweischneidiges Schwert, das nur akzeptabel scheint, wenn die Probanden genau wissen, worauf sie sich einlassen.
Phase II - Profit vor Patienteninteressen?
Im Aufenthaltszimmer der onkologischen Station der Universitätsklinik in Halle an der Saale sitzt Iris Klar. Für sie war es keine Frage, ob sie an einer klinischen Studie teilnehmen möchte. Geld bekommt sie dafür auch nicht.
"Ich hatte eigentlich keine andere Option mehr", sagt sie. "Die Tabletten, das Ruxolit, hat nicht mehr angeschlagen und dann greifst du vielleicht nach jedem Strohhalm, den man hat. Und ich sag mal, was Besseres kann mir vielleicht nicht passieren. Ich kann ja auch zu jeder Zeit die Studie abbrechen. Wenn ich sage, ich mache das nicht mehr mit. Aber dann weiß ich auch nicht, was ich mache."
Iris Klar leidet an Polyzythämie. Ihr Körper produziert übermäßig viele Blutkörperchen: "Ich habe eigentlich alles zu viel, im Volksmund sagt man dickes Blut. Seit 1991 gehe ich in die Hämatologie."
Sie bekommt zunächst Aderlässe, danach jahrelang ein Mittel zur Blutverdünnung. Als das nicht mehr wirkt, wird sie 2009 in ihre erste klinische Studie aufgenommen. Sie bekommt Ruxolitinib. Sie verträgt es sehr gut, die Nebenwirkungen sind gering.
Hoffen auf einen neuen Wirkstoff
Doch nach einigen Jahren schlägt auch diese Therapie nicht mehr an. Ihre Werte werden immer schlechter. 2019 dann die gute Nachricht, auf die Iris Klar und ihre Ärztin sehnsüchtig gewartet haben: Ein neuer Wirkstoff soll in einer Studie getestet werden. Zum zweiten Mal wird sie Studienteilnehmerin.
"Das Medikament, das kriegen sie halt jetzt nur in ganz wenigen Zentren", erzählt ihre Ärztin. "Hat sie erzählt, dass sie die Erste in Europa war, die das gekriegt hat?"
"001! Nicht 007", fügt Iris Klar hinzu.
"001! Nicht 007", fügt Iris Klar hinzu.
001 von 132 Patientinnen und Patienten europaweit. Die Studie eines kleinen US-amerikanischen Pharmaunternehmens ist in Phase II, das heißt: Die Substanz wird an kranken Menschen getestet. Mit bis zu zweihundert Patienten ist die Testgruppe zudem größer als in Phase I. Nun geht es darum, zu prüfen, wie wirksam ein Medikament ist und die richtige Dosierung zu finden. Auch mögliche Nebenwirkungen werden untersucht.
Contergan-Skandal als Auslöser für Arzneimittelgesetz
Als 1954 Wissenschaftler von Chemie Grünenthal den Wirkstoff Thalidomid untersuchen, gibt es noch keine umfassenden Arzneimittelgesetze. Es ist dem Hersteller überlassen, wie er neue Substanzen testet. Im Tierversuch zeigt Thalidomid weder echte Wirkungen noch Nebenwirkungen. Erst beim Versuch an Menschen zeigt sich das Potenzial als Schlafmittel.
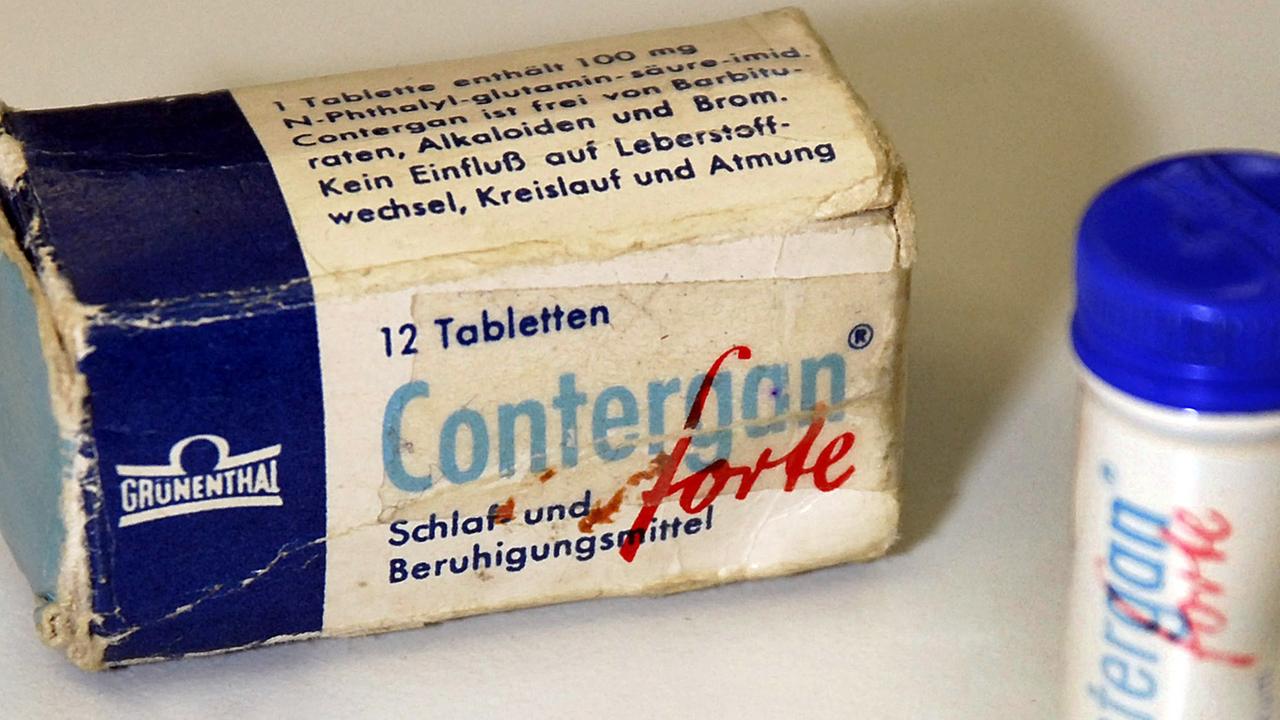
Der Wirkstoff Thalidomid kam in den 1950er-Jahren unter dem Namen "Contergan" als Schlafmittel auf den Markt.© Stefan Puchner / dpa
1957 kommt es unter dem Namen Contergan auf den deutschen Markt und ist rezeptfrei erhältlich. "Unschädlich wie Zuckerplätzchen" – so rühmen Firmen-Vertreter die Pillen. Millionen Bundesbürger, vor allem Frauen, greifen zu auf der Suche nach einem ruhigen Schlaf.
Sie erwachten in einer Katastrophe: Contergan ist für Fehlbildungen bei Neugeborenen verantwortlich. Das Mittel wird vier Jahre nach seiner Einführung vom Markt genommen. In Folge des Skandals beschließt der Bundestag 1976 das Arzneimittelgesetz, das bis heute gültig ist. Es regelt ein einheitliches Verfahren zur Medikamentenzulassung. Mit pharmakologischen und klinischen Versuchen müssen Hersteller nun nachzuweisen, dass ein Mittel nicht nur wirkt, sondern auch sicher ist.
Ausführliche Studienprotokolle und Prüfpläne
Für jede klinische Studie muss zunächst eine Hypothese formuliert werden. Was soll das Medikament bewirken? Gegen welche Krankheit kann es eingesetzt werden? Wer darf an der Studie teilnehmen? Die Hersteller müssen zudem ausführliche Studienprotokolle und Prüfpläne verfassen.
"Aber bei dieser Studie, die ich hier mitmache", sagt Iris Klar, "da war ich von März bis Ende August, jeden Dienstag in Halle. Also das war sehr aufwendig."
Auch in Phase II wird genau überwacht, wie sich das Medikament auf die Indikation auswirkt, also auf die Krankheit, die es bekämpfen soll.
Für Patientin Iris Klar begann die Studie mit einem guten Ergebnis: "Und nach den ersten Tabletten haben wir dann auch schon den Erfolg gesehen, dass die Blutwerte tiefer gegangen sind, viel tiefer, also solche Blutwerte, wie ich jetzt habe, hatte ich 30 Jahre nie."
Täglich muss sie den aktuellen Stand dokumentieren: Die Einnahme des Medikaments und wie sie sich fühlt, tippt sie in ein Smartphone und schickt die Daten an die Studienzentrale zur Auswertung: "So, Daten wurden erfolgreich gesendet."
Volkskrankheiten für Pharmaunternehmen lukrativ
Iris Klars Bluterkrankung ist selten: Schätzungen zufolge leiden um die 24.000 Menschen in Deutschland daran. Für Pharmaunternehmen eine unattraktive Krankheit: Die Entwicklungskosten für das neue Medikament sind hoch; der Absatzmarkt aber klein.
Lukrativer sind Volkskrankheiten. Der Arzneimittelindustrie bringt das den Vorwurf ein, ihre Forschung am Profit auszurichten und dabei das Patientenwohl zu vernachlässigen.
Ein Beispiel ist die Geschichte des Cholesterinsenkers Lipobay, Anfang der 2000er-Jahre. Der Hersteller Bayer muss das Mittel drei Jahre nach der Zulassung vom Markt nehmen. Weltweit waren mehr als 100 Menschen nach der Einnahme gestorben, Tausende erlitten schwere Nebenwirkungen. Bayer zahlte mehr als eine Milliarde Euro an Entschädigungen.
Bis heute steht der Vorwurf im Raum, dass der Konzern früh von den Gefahren des Medikaments wusste und sie vertuscht hat.
"Sicherheitssignale sind immer extrem relevant für uns", sagt Ute Simon. Sie leitet die Klinische Forschung bei Novartis. Die deutsche Niederlassung des Schweizer Unternehmens liegt in Nürnberg. Ein langes, dreigeschossiges Glasgebäude unweit der historischen Altstadt.
"Wenn es schwerwiegende unerwünschte Nebenwirkungen sind", sagt sie, "meldet der Prüfarzt sie innerhalb von 24 Stunden. Alle Daten aus allen Ländern laufen natürlich in einer Datenbank zusammen. Und manchmal wird dann aus einem kleinen Fall, wenn man merkt, dass weltweit schon zehn Fälle diesbezüglich gemeldet wurden, dann wird natürlich geschaut: Können wir das Prüfpräparat tatsächlich weiterentwickeln oder sind die Sicherheitssignale bedenklich."
Unabhängige Ethikkommission muss zustimmen
Die Pharmaindustrie betont, dass die Patientensicherheit an erster Stelle stehe, und verweist auf staatliche Kontrollen: Tests an Menschen sind genehmigungspflichtig. Außerdem muss eine unabhängige Ethikkommission zustimmen. Die endgültige Zulassung für ein neues Medikament erteilt eine staatliche Behörde.
Bei ihr müssen die Hersteller belegen, dass ein neues Arzneimittel wirkt und unbedenklich ist – nachgewiesen in klinischen Studien. Allerdings prüfen die Behörden nur die vorgelegten Dokumente. 80 Prozent der Studien in Deutschland bezahlt die Pharmaindustrie. Das sind jährlich etwa acht Milliarden Euro für Forschung und Entwicklung.
"Ein Pharmakonzern ist ein Wirtschaftsunternehmen", sagt Ute Simon. "Also da wo wir hinten keine Gewinne erzielen, können wir vorne nicht forschen. Also wir forschen ja, um schlussendlich eine Zulassung zu bekommen."
Das Ziel medizinischer Forschung ist der Fortschritt, also eine bessere Therapie mit einem wirksameren Medikament. Dabei nehmen Pharmaunternehmen eine Janusrolle ein: Einerseits bringen sie Heil, andererseits verdienen sie damit Geld.
Phase III – Schnelle Hilfe oder schnelles Geld?
"Letztendlich ist es natürlich ein wichtiger Zweig der klinischen Forschung, Behandlungen, die existieren, zu verbessern", sagt Thomas Weber. Er ist Oberarzt für Innere Medizin an der Universitätsklinik in Halle an der Saale.
Er behandelt vor allem Patienten mit Lymphdrüsenkrebs: "Es ist natürlich so, dass es in der Onkologie einige Erkrankungen und Erkrankungssituationen gibt, wo wir leider medizinisch immer noch sehr unzufrieden sind mit dem, was wir anbieten können. Das ist einfach nicht gut."
Und für die Patienten bedeutet ein neuartiges Medikament einen Funken Hoffnung.
"Ja und nun hat mir mein Onkologe empfohlen, an dieser Studie hier teilzunehmen", sagt Jürgen Didwiszus. "Ich habe mich freiwillig dazu entschieden und hoffe, dass das bisschen was bringt für mich."
Letzte Stufe vor der Zulassung – mit Losentscheid
Er nimmt an Phase III einer Studie teil – es ist die letzte Stufe vor der Zulassung. Jetzt muss sich zeigen, ob ein neuer Wirkstoff auch in der Masse wirkt und tatsächlich unbedenklich ist. Getestet wird das mithilfe von großen, diversen Patientengruppen unter Alltagsbedingungen.
"Dann wurde ja auch gesagt, dass diese Studiengruppe aufgeteilt wird mit Losverfahren einmal in die reine Chemotherapie", erzählt Jürgen Didwiszus. "Und die andere Gruppe macht diese zusätzliche Immuntherapie, so nennt sich das wohl. Ja da werden wir sehen, was das Los entscheidet."
Eine fifty-fifty Chance. Was ungerecht klingt, ist der Goldstandard im Studiendesign: die randomisierte kontrollierte Studie. Entwickelt in London der 1940er-Jahre.
Großbritannien nach dem Zweiten Weltkrieg: Im Land breitet sich Lungentuberkulose aus, die Krankheit ist die häufigste Todesursache bei jungen Erwachsenen. Als einzige Therapie können die Ärzte Bettruhe verordnen – ein Medikament gibt es nicht. Doch aus den USA kommen vielversprechende Nachrichten: Das Antibiotikum Streptomycin scheint die Tuberkulose-Bakterien zuverlässig zu bekämpfen.
Doch Großbritannien kann nur 50 Kilo des Wirkstoffs kaufen – das reicht für 50 Patienten. Es stellt sich eine schwere ethische Frage: Wie wählt man die Patienten aus, die in den Genuss der womöglich lebensrettenden Therapie kommen?
Nummern in verschlossenen Umschlägen
Der Statistiker Austin Bradford Hill überzeugt das zuständige Medical Research Council Streptomycin in einer randomisierten Studie zu verteilen. In verschlossenen Umschlägen verteilt er Nummern an Krankenhausstationen, die bei jeder neuen Patientenaufnahme geöffnet werden.
Der Zufall teilt die Patienten so in zwei Gruppen: Die eine bekommt das Antibiotikum und Bettruhe, die andere bekommt als Therapie nur Bettruhe verordnet. Erstmals werden so Standardbehandlung und ein neuer Ansatz gleichzeitig miteinander verglichen.
Das Prinzip der randomisierten kontrollierten Studie gilt bis heute: Das Ziel ist es nachzuweisen, dass ein neues Medikament wirksamer oder besser verträglich ist als eine bestehende Therapie oder ein Placebo. Also ein Mittel ohne Wirkstoff.
Heute sind die Studien meist doppel-verblindet – das bedeutet, dass weder Patient noch Arzt wissen, zu welcher Gruppe sie gehören. Damit ein Kranker wie Jürgen Didwiszus das Risiko für sich besser einschätzen kann, muss ihn sein behandelnder Mediziner vor der Studienteilnahme aufklären.
"Und dann gibt es einen experimentellen Arm", sagt Thomas Weber. "Da wird zu diesen zwei Medikamenten, die etabliert sind, noch ein neues Medikament dazu genommen. Das heißt, Nivolumab. Das Nivolumab wirkt ganz anders, das ist keine Chemotherapie, sondern das ist ein Medikament, was letztendlich dazu führt, dass das Immunsystem diese Krebszellen wiedererkennt und bekämpfen kann."
Doch es kann sein, dass der Patient nicht auf das neue Medikament anspricht. Oder gravierende Nebenwirkungen in der Krebstherapie auftreten.
"Aber dann, wenn dieser Fall eintritt, würde man hier die Studie beenden" erklärt der Oberarzt. "Und wir müssten dann einfach gucken, wie wir die Erkrankung weiter behandeln. Mit der normalen Therapie haben wir, denke ich, eine gute Chance, die Erkrankung zurückzudrängen. Wir hoffen, dass wir durch diese Hinzunahme des Antikörpers die Erkrankung sogar komplett zurückdrängen können, dass wir sie nicht mehr sehen. Und in der Studie sind schon einige Patienten behandelt worden und die Erfahrungen da sind sehr gut."
Vielversprechende Ergebnisse erhöhen Zeitdruck
Gerade wenn ein Medikament besonders vielversprechend ist und eine gute Alternative zu bisherigen Therapien darstellt, steigt der Druck: Der Druck, es möglichst schnell auf den Markt zu bringen.
"Die Dringlichkeit, die man dahinter vermuten muss, ist, dass man möglichst rasch neue Arzneimittel den Patientinnen und Patienten und letzten Endes den Ärzten für die Therapie zur Verfügung stellen möchte", sagt Gerd Glaeske. Er forscht an der Universität Bremen über Arzneimittelversorgung.

Die Gleichung "Neu ist immer besser"' stimme überhaupt nicht, sagt Gerd Glaeske.© picture alliance/dpa/Geisler-Fotopress
Im Auftrag etwa von Krankenkassen bewertet er neue Wirkstoffe: "Ich bin zu der Überzeugung gekommen, dass die Gleichung 'neu ist immer besser' überhaupt nicht stimmt, sondern wir haben natürlich viele neue Arzneimittel im Markt. Bei vielen dieser Arzneimittel sehen wir auch bei einigen zumindest, dass es einen Fortschritt in der Therapie für die Patientinnen und Patienten gibt. Bei anderen wird dieser Fortschritt nur behauptet."
Glaeskes Einschätzung deckt sich mit Daten anderer Forscher. Das unabhängige Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen hat mehr als 200 neue Arzneimittel bewertet. Ergebnis: Dreiviertel hatten keinen echten Zusatznutzen.
Sie wirken also nicht besser als etablierte Medikamente, sind aber meist deutlich teurer. Außerdem fehlen langfristige Erfahrungswerte. Am schlechtesten schnitten die Wirkstoffe ab, die beschleunigt zugelassen worden waren.
Beschleunigte Zulassung schafft Probleme
"Wenn man jetzt eine verkürzte Studie durchführt", sagt Gerd Glaeske, "das heißt, im Prinzip vorzeitige Zulassungen ausspricht auf der Basis von Studiensituationen, die nicht bis zum Ende der Phase III durchgeführt werden, hat man im Grunde genommen ein Kenntnisdefizit, insbesondere auch, was die unerwünschten Wirkungen betrifft."
Ein Beispiel dafür ist der Wirkstoff Olaratumab, der im November 2016 auf den Markt kam. Der Hersteller bekam im beschleunigten Verfahren eine Zulassung für die Therapie von bösartigen Tumoren der Weichteile. Grundlage waren die Ergebnisse aus Phase II der klinischen Studien, an der nur 148 Erkrankte teilgenommen hatten.
Der Hersteller behauptete, dass die Patienten mit dem neuen Wirkstoff fast ein Jahr länger leben würden als bei der Standardtherapie. Die deutschen Behörden genehmigten daraufhin den Einsatz als Medikament, verlangten aber, dass Phase III der Studie nachgeholt wird.
Erst hier zeigte sich: Das Krebsmittel konnte die Versprechen nicht einhalten – Mitte vergangenen Jahres wurde die Zulassung deshalb entzogen.
"Ein Risiko von eins zu 10.000 wird man erst mit 30 bis 40.000 Patienten feststellen können", erklärt Gerd Glaeske, "sodass bei den verkürzten Studien insbesondere in der Onkologie, bei denen man in der Phase II vielleicht 200, 300, 400 Patienten hat, eigentlich überhaupt keine vernünftige Risiko-Nutzen-Bewertung machen kann. Und im Grunde genommen diese Risiko-Nutzen-Bewertung auf die Zeit nach der Zulassung verschiebt. Und das ist etwas, was mich dann schon bekümmert."
Labor zur Herstellung von Krebsmedikamenten: Viele Patienten warten auf neue Therapien und greifen nach jedem Strohhalm.© picture alliance / dpa / Rolf Vennenbernd
Gerade im Bereich der Krebstherapie ist die Diskussion meist emotional: Denn auf der einen Seite stehen Patienten, die auf neue Therapien warten und nach jedem Strohhalm greifen. Auf der anderen Seite Unternehmen, die bereit sind jede Hoffnung für teures Geld zu verkaufen.
Ein schier unauflösbares Dilemma: Gute Medikamente sollen schnell zum Patienten kommen, gleichzeitig aber müssen die wissenschaftlichen Standards hochgehalten werden.
Phase IV: Statistische Tricks oder seriöse Wissenschaft?
In der vierten und letzten Phase wird das Medikament im Alltag getestet. Die Hoffnung: Durch große Patientengruppen lassen sich verlässliche Ergebnisse erzielen.
"Versorgung ist die, die uns eigentlich interessiert, weil es da um die Patientinnen und Patienten geht, die tatsächlich im Krankenhaus in der Praxis von den Ärzten gesehen werden, die dann keine Chance mehr haben auszuwählen", sagt Gerd Glaeske.
Selektierte Patientengruppen, so wie in Phase I bis III, lieferten lediglich selektierte Ergebnisse, so Gerd Glaeske. Seltene Nebenwirkungen etwa zeigen sich häufig erst, wenn viele Menschen einen Wirkstoff einnehmen. Menschen mit unterschiedlichen Krankheitsgeschichten, unterschiedlichen Geschlechts. Echte Patienten.
"Das ist eine ganz schwierige Situation für Ärztinnen und Ärzte", sagt er, "die ja nun auch in unterschiedlicher Weise von Erkenntnissen oder von Publikationen, die zum Teil ja von der Pharmaindustrie gelenkt werden, dann Rückschlüsse ziehen müssen auf ihre Behandlung. Das heißt, wir haben eine Situation, wo wir durchaus einen Erkenntnis-Bias haben, wie wir das nennen. Also eine verzerrte Darstellung von Ergebnissen aus den Studien von pharmazeutischen Herstellern, die eher ja die Wirksamkeit, die Nützlichkeit, den Fortschritt darstellen, und weniger die Probleme, die mit diesen Arzneimitteln verbunden sind."
Alltagstest nicht zwingend vorgeschrieben
Der vierstufige Idealtypus einer randomisiert-kontrollierten Studie ist teuer und dauert lange. Vor allem: Phase IV kann die Industrie machen, muss sie aber nicht.
"Grundsätzlich ist ein schwieriges Wort, weil: Was heißt grundsätzlich? Wir machen viel Phase IV, weil das für den deutschen Markt und für unsere Ärzte extrem wichtig ist", sagt Ute Simon. "Das sind Fragen, die dann tatsächlich auch über kleinere Projekte beantwortet werden können. Wenn das jemand an uns heranträgt."
In Phase IV beobachten ausgewählte Ärzte die vorgeschriebene Anwendung des Medikaments. Die Mediziner müssen Nebenwirkungen melden. Alles passiert ohne Prüfplan, unter realen Praxisbedingungen.
"Also einmal muss man sich davon verabschieden, dass klinische Studien fehlerfrei sein können", sagt Gerd Antes. Er ist Mathematiker und hat sein Berufsleben in der evidenzbasierten Medizin verbracht.
Er hat viele Jahre das deutsche Cochrane Institut geleitet. Das Ziel von Cochrane ist es, Gesundheitsfragen auf Grundlage von hochwertigen wissenschaftlichen Studien zu beantworten. Und hier kommt die Statistik ins Spiel.
"Ganz einfach deswegen, weil die Menschen alle unterschiedlich sind und weil ganz viele Einflüsse dafür sorgen, dass etwas mit Unsicherheit behaftet ist, was dort als Ergebnis auftaucht", erklärt Gerd Antes. "Die Methodik, die wir haben, die wurde ja entwickelt über die letzten 20, 30, 40 Jahre bei Studien. Und alles, was ich damit erreiche, sind Wahrscheinlichkeiten. Dass zum Beispiel das neue Medikament besser ist als das alte oder die Wahrscheinlichkeit dafür, dass es wirkt. Kein Medikament wirkt 100 Prozent. Das heißt, eigentlich ist das, was der Arzt mit einem macht, immer wieder auch ein Versuch - und er versucht, Erfolg zu haben mit einem gewissen Medikament."
"Teilweise kolossale Fehler in der Durchführung"
Und Erfolg wird dadurch definiert, dass ein Mittel besser ist als die Standardtherapie oder das Placebo. Dass es beispielsweise die Lebenszeit verlängert, auch wenn die Nebenwirkungen stärker sind.
"Dazu kommen dann eben teilweise kolossale Fehler in der Planung, in der Durchführung und dann eben auch ganz stark in der Berichterstattung", sagt Gerd Antes. "Vorne kann es sein, dass man einfach nicht richtig nachgedacht hat, denn während des Verlaufs gibt es teilweise richtig schwere Fehler. Man muss aber auch ganz ehrlich sagen: An vielen Stellen wird dann auch wirklich manipuliert."
Antes meint damit nicht, dass Daten gefälscht oder erfunden werden. Manipuliert werde subtiler: Etwa indem so gewichtet wird, dass der Nutzen eines neuen Wirkstoffs deutlicher zum Vorschein kommt. Oder indem unerwünschte Daten unterschlagen werden. Denn ein zentrales Problem klinischer Studien ist ihre mangelnde Transparenz - gerade unliebsame Ergebnisse verschwinden oft in den Schubladen der Auftraggeber, sprich: der Pharmakonzerne.
Etwa die Hälfte der Studien kommt nicht an die Öffentlichkeit
"Ich bin einig mit dem Wort Skandal ziemlich sparsam", sagt Gerd Antes. "Aber das ist eigentlich ein chronischer Skandal. Wir wissen seit 1986, da gab es eine sehr überzeugende Studie in Australien, in Sydney: Dass circa 50 Prozent, von den Studien, die begonnen wurden, nie dorthin kommen, wo sie hingehören, nämlich an die Öffentlichkeit. Und dafür gibt es verschiedene Gründe. Einer ist natürlich, dass die Ergebnisse nicht gefallen. Dann gibt es aber auch ein Wechselspiel von den Zeitschriften, die die Dinge nicht gerne sehen, die nicht spektakulär sind, die nicht das erfüllen. Das klingt etwas böse, aber auch die wissenschaftlichen Zeitschriften haben teilweise Mechanismen, die man eigentlich nur bei der Bildzeitung vermuten würde."
Wenn die Ergebnisse aus klinischen Studien nicht das Licht der Öffentlichkeit erblicken, kann das fatale Folgen haben: Ein Beispiel ist ein Medikament gegen Herzrhythmusstörungen, entwickelt in den 1980er-Jahren. Schon früh gab es Hinweise, dass die Sterblichkeit von Patienten dramatisch anstieg, die das Mittel einnahmen. Doch der Hersteller veröffentlichte die Studie nicht.
Erst 15 Jahre später konnten unabhängige Mediziner nachweisen, wie gefährlich der Wirkstoff ist. In seinem Buch "Deadly Medicine" hat der US-amerikanische Autor Thomas Moore den Fall aufgearbeitet. Er kommt zu einem dramatischen Schluss: Der Medikamentenskandal habe mehr Menschen getötet, als US-Soldaten in den Kriegen von Korea und Vietnam gefallen sind.
"Dort hat man Jahre gebraucht, um es zu begreifen", erzählt Gerd Antes. "Und da ist der Mechanismus nicht nur der Publikation zuzuordnen, sondern eben auch dem gesamten Ablauf. Aber da ist es eben das Faszinierende, dass eine Studie gemacht worden ist. Es sind nicht viele, sondern eine einzige, eine kleine Studie, die gezeigt hat, dass dieses Medikament schädlich ist in der Indikation. Und genau diese eine Studie ist nicht publiziert worden."
Womöglich ist das ein Einzelfall, doch er zeigt ein Symptom der modernen, evidenzbasierten Medizin: Die klinische Forschung verheißt Fortschritt, Linderung oder Heilung von Krankheiten, ein längeres Leben. Dafür kommen immer neue, bessere Wirkstoffe auf den Markt.
Doch es ist die Pharmaindustrie, die maßgeblich bestimmt, gegen welche Leiden neue Medikamente entwickelt werden und wie genau die Studien ablaufen. Die Priorität dabei: ein markttaugliches Mittel. Und dabei kann das Wohl der Patienten in den Hintergrund geraten.
"Ich habe immer das Gefühl, der Konflikt oder was immer so das Spannungsfeld ist: Gesellschaft versus Industrieinteressen. Und die Interessen der Patienten sind aber nicht unbedingt die Interessen der gesamten Gesellschaft - und letztendlich geht es um die Patienten", sagt der Arzt Thomas Weber.
Die Erstausstrahlung des Features war am 30.1.2020.
Autorin: Duška Roth
Sprecherin und Sprecher: Lisa Hrdina und Maximilian Held
Regie: Friederike Wigger
Ton: Martin Eichberg
Redaktion: Martin Mair