Wie Forscher neue Antibiotika aufspüren
25:30 Minuten
Gegen immer mehr krankmachende Bakterien sind gängige Antibiotika wirkungslos, manchmal sogar alle verfügbaren. Die Suche nach neuen Wirkstoffen läuft daher weltweit auf Hochtouren. Aber der Weg zum Medikament ist weit - viele Substanzen scheitern.
Die Filmmusik zum Thriller "Der dritte Mann". Wer den Klassiker kennt, sieht jetzt Männer mit Hut und wehendem Mantel durch ein düsteres, geteiltes Nachkriegs-Wien laufen. Der Grund, aus dem hier gemordet, betrogen und bis in die Tiefen der Kanalisation gejagt wird, ist: Penicillin. Das Antibiotikum ist – gerade in diesen Zeiten – ein kostbares Gut.
"Wissen sie, was Penicillin ist?"
"Klar."
"In Wien gibt es natürlich nicht genug Penicillin. Aber es ist zu kriegen. Gestohlenes aus unseren Lazaretten."
"Klar."
"In Wien gibt es natürlich nicht genug Penicillin. Aber es ist zu kriegen. Gestohlenes aus unseren Lazaretten."
So kostbar, dass noch weitere Verbrechen begangen werden. Das Antibiotikum wird gestreckt und auf dem Schwarzmarkt verkauft. Die Auswirkungen sind dramatisch: "Männer mit faulenden Gliedmaßen, Frauen mit Kindbettfieber, und dann die Kinder mit Hirnhautentzündung."
Penicillin ist längst nicht mehr das einzige Antibiotikum
Ein Grund, weshalb die Kranken leiden: Das Antibiotikum ist zu schwach, um sie gesund zu machen – und bewirkt das Gegenteil: Einige Erreger entwickeln Strategien, um das Penicillin unschädlich zu machen und breiten sich erneut im Körper aus. Sie sind resistent geworden. Die Waffe wirkt nicht mehr.

Alexander Fleming (1881-1955): Als einer der Entdecker von Penicillin erhielt der schottische Mediziner und Bakteriologe den Nobelpreis.© imago / Zuma / Keystone
Dieser Kampf ist sehr real und wird noch immer gekämpft, auch wenn Penicillin bei weitem nicht mehr das einzige verfügbare Antibiotikum ist. Doch auch die Krankheitserreger haben aufgerüstet und neue Resistenzen entwickelt – manche sogar gegen mehrere Wirkstoffe. Heute sterben nach Berechnungen der Europäischen Seuchenbehörde europaweit pro Jahr rund 33.000 Menschen an einer Infektion mit multiresistenten Keimen.
Die Situation in Deutschland sei grundsätzlich nicht schlecht, sagt Georg Häcker, Leiter des Instituts für Medizinische Mikrobiologie und Hygiene an der Universität Freiburg. Und doch:
"Es gibt immer wieder Einzelfälle, da haben wir ganz große Schwierigkeiten, noch ein Antibiotikum zu finden", sagt Georg Häcker. "Weil die Bakterien schon resistent gegen ganz viele geworden sind. Es gibt aber auch Länder in der Welt – und selbst in Südeuropa haben wir zum Teil diese Probleme –, da sind diese ganz resistenten Bakterien sehr viel häufiger. Und wir rechnen jederzeit damit, dass eine Welle auch uns erreicht. Es lässt sich nicht wirklich vorhersagen, ob diese Welle kommen wird, wann sie kommen wird, wie gut wir das verhindern können. Aber wir fürchten sie ständig und müssen ständig da auf der Hut sein.
Alle 26 in den USA verfügbaren Antibiotika wirkungslos
2016 starb in den USA eine Frau an einer Infektion, nachdem alle 26 Antibiotika, die zu diesem Zeitpunkt in den Vereinigten Staaten zugelassen waren, versagt hatten. Infiziert hatte sie sich mit multiresistenten Klebsiellen. Die Patientin war zuvor in Indien wegen eines Knochenbruchs behandelt worden, der sich entzündet hatte. Die US-amerikanische Seuchenkontrollbehörde CDC betont in ihrem Bericht, Fälle wie dieser seien äußerst selten.
Knapp 90 Prozent der multiresistenten Keime, die im Rahmen eines nationalen Programms zur Beobachtung neu aufkommender Infektionen gesammelt worden seien, seien empfindlich gegenüber mindestens einer Klasse von Antibiotika, können also behandelt werden. Aber es wird enger, denn dass sich Resistenzen entwickeln, gilt als sicher. Es ist nicht die Frage nach einem Ob, sondern nach dem Wann. Genau deshalb ist die Suche nach neuen Wirkstoffen so wichtig, so entscheidend.
Tanja Schneider ist eine von denen, die suchen – und die finden. Die habilitierte Biologin leitet das Institut für Pharmazeutische Mikrobiologie an der Universität Bonn.
"Wir sind jetzt hier in einem S2-Labor, in einem Labor der Sicherheitsstufe zwei", erklärt Tanja Schneider. "Hier arbeiten wir unter anderem mit Staphylococcus aureus, MRSA beispielsweise, der auch genetisch manipuliert wird."
In der Schreckenskammer der Krankenhauskeime
Staphylococcus aureus ist, wenn man so will, der Medienstar unter den multiresistenten Erregern, genauer: Der Typ, der auch gegen das Antibiotikum Methicillin resistent ist, abgekürzt MRSA. So gesehen ist das Labor, in dem wir stehen, eine Art Schreckenskammer der Krankenhauskeime: Hier gibt es alles. Klebsiellen, die Lungenentzündung verursachen oder Enterokokken, die nach Operationen Infektionen verursachen können.
Und von hier aus gelang Tanja Schneider und ihrer Arbeitsgruppe in Zusammenarbeit mit US-amerikanischen Wissenschaftlern vor vier Jahren ihr bislang größter Coup: Im Januar 2015 erschien in der Fachzeitschrift "Nature" ein Artikel, dessen Titel – gemessen an der branchenüblichen Zurückhaltung bei solchen Formulierungen – geradezu euphorisch klingt: "A new antibiotic kills pathogens without detectable resistance".
Ein Antibiotikum, das Pathogene – also Krankheitserreger – tötet. Und zwar ohne, dass sich bislang Resistenzen feststellen lassen. Der Name: Teixobactin. Die Substanz wirkt nicht nur gegen MRSA, sondern auch gegen Enterokokken. Besonders effizient ist sie gegen den Erreger von Tuberkulose. In den USA laufen aktuell Tests dazu, ob sich Teixobactin tatsächlich als Medikament eignet. Ein großer Hoffnungsträger. Dazu kommt: Die Forschenden halten die Gefahr, dass Resistenzen gegen den Wirkstoff auftreten, auch langfristig für sehr gering.
"Es wirkt anders als viele andere", sagt Tanja Schneider, "und es ist strukturell komplett etwas Neues, also so eine Substanz kannte man vorher nicht, also chemisch eine absolute Neuheit. Und der Wirkmechanismus unterscheidet sich in Details von anderen – die allerdings extrem wichtig sind, um letztlich die Potenz der Substanz zu erklären."
Teixobactin verhindert, dass die krankheitserregenden Bakterien eine neue Zellwand aufbauen können, wenn sie sich teilen. Das tut auch Penicillin. Anders als Penicillin aber greift Teixobactin die Moleküle an, die das Bakterium nicht verändern kann, ohne den eigenen Tod zu riskieren. Außerdem wirkt Teixobactin gleich an mehreren Stellen.
Teixobactin aus Bodenbakterium isoliert
Isoliert wurde der Wirkstoff aus einem Bodenbakterium, Eleftheria terrae, erklärt Tanja Schneider: "Die meisten Antibiotika, die wir heute in der Anwendung haben, werden von Boden-Mikroorganismen produziert. Letztlich im Kampf um Ressourcen, um sich Ressourcen zu sichern, die von anderen Mikroorganismen verbraucht werden würden. Daher ist es naheliegend, dass man beispielsweise im Boden, aber auch in Sedimenten von Meeren nach solchen neuen Produzenten sucht."
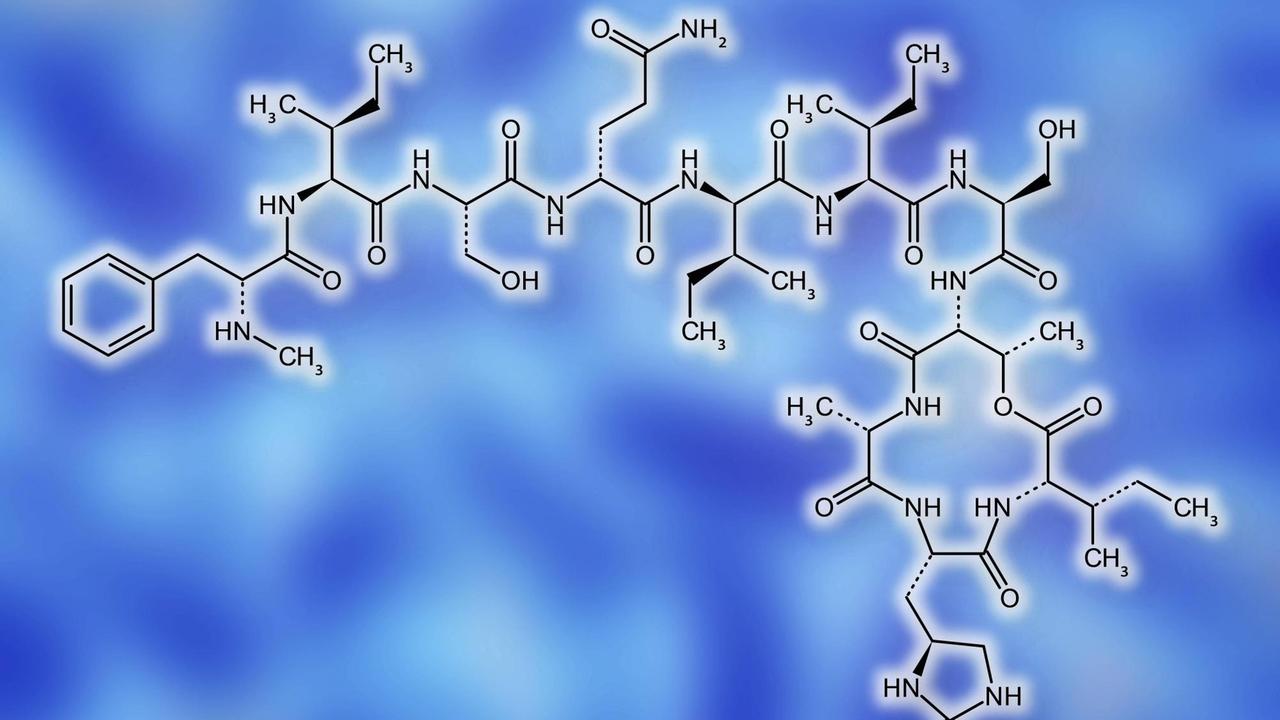
Der Wirkstoff Teixobactin wurde aus dem Bodenbakterium Eleftheria terrae isoliert.© imago / Science Photo Library / Alfred Pasieka
Das Prinzip dahinter lautet so: Dort, wo sich viele Mikroorganismen – etwa Bakterien, Pilze und Einzeller – tummeln, gibt es viel Konkurrenz. Und Antibiotika sind ein sehr effizientes Mittel, um sich gegen Nachbarn zu behaupten, die es auf die gleichen Nährstoffe abgesehen haben.
Georg Häcker formuliert das so: "Antibiotika sind Mittel der chemischen Kriegsführung zwischen Mikroorganismen."
Alexander Fleming, der Entdecker des Penicillins, hat genau das mit eigenen Augen gesehen: 1928 findet der Bakteriologe nach einem Sommerurlaub in seinem Labor Bakterienkulturen vor, die von einem Schimmelpilz befallen sind. Doch statt sie wegzuwerfen, schaut er genauer hin: In der Umgebung des Schimmels wachsen keine Bakterien mehr. Fleming folgert: Eine Substanz des Pilzes der Gattung Penicillium muss die Bakterien abgetötet haben. Ein bahnbrechender Fund.
Penicillin-Entdeckung startet Antibiotika-Boom
Was folgt, sind Jahre, die als "die goldenen" in die Geschichte der Antibiotikaforschung eingehen: Cephalosporin, Monobactam, Carbapenem, Chinolon, Tetrazyklin, Ampicillin, Sulfonamid, Chloramphenicol ... In den folgenden Jahren werden mehr als 80 Substanzen gefunden, weiterentwickelt und angewandt.
Der Wettlauf aber bleibt, denn auch die Keime entwickeln immer neue Resistenzmechanismen, um Antibiotika unschädlich zu machen: Sie schneiden die Moleküle in Stücke, werfen sie wieder aus der Zelle und verändern sich so, dass die Wirkstoffe ihr Ziel nicht mehr erkennen und ins Leere laufen.
"Es wird jetzt immer schwerer, neue Substanzen zu finden", sagt Tanja Schneider. "Und dafür ist es umso wichtiger, dass man zum einen neue Methoden etabliert, zum anderen aber auch an anderen Standorten beispielsweise sucht, also eher ungewöhnliche Habitate, wo man vielleicht noch nicht geschaut hat."
Gesucht – und gefunden – wird mittlerweile in Heilerde aus Irland, in der Erde von Mangrovenwäldern, in der Antarktis und selbst in der Schleimschicht junger Fische. Aber – Ausnahmen bestätigen die Regel – manchmal hat man ganz in der Nähe Glück.
"Zum Beispiel ist dieses Teixobactin aus einer Bodenprobe isoliert worden, die aus dem Garten kam", erklärt Tanja Schneider. "Da wurde mit dem Spaten ein Stück Erde ausgestochen, und das war der Hintergarten von einer Mitarbeiterin von Novobiotic Pharmaceuticals. Und das war jetzt überhaupt nichts Besonderes. Und ich würde wetten, dass, wenn ich das in meinem Garten mache, dass ich da ein ganz ähnliches Bakterium finde."
Schwierige Suche nach geeigneten Bakterien
Ein riesiges Reservoir, an das aber schwer heranzukommen ist.
"Wir wissen mittlerweile aus metagenomischen Untersuchungen", sagt Tanja Schneider, "dass wir 99 Prozent der Bakterien, die in unserer Umwelt sind, überhaupt noch gar nicht kultivieren konnten. Das heißt, die sind zwar im Boden, können sich dort auch vermehren und wachsen, können das aber nicht im Labor."
Wissenschaftler wie Tanja Schneider mussten sich etwas einfallen lassen: "Da haben dann die Kollegen aus den USA einen Trick angewendet und kultivieren die Bakterien in ihrer eigenen Umgebung, das heißt: im Boden."
Dazu wird eine Bodenprobe sehr stark verdünnt und in ein spezielles Kulturgefäß gefüllt.
"Dann wird das Ganze versiegelt mit Membranen", erläutert Tanja Schneider, "sodass Nährstoffe zu den Bakterien gelangen können, die Bakterien aber nicht nach außen, und dann bringt man das Ganze wieder in die Erde ein, für zwei bis vier Wochen, und wartet dann, ob sich die Bakterien vermehren können."
Kleine Zellhaufen wandern für Versuche ins Labor
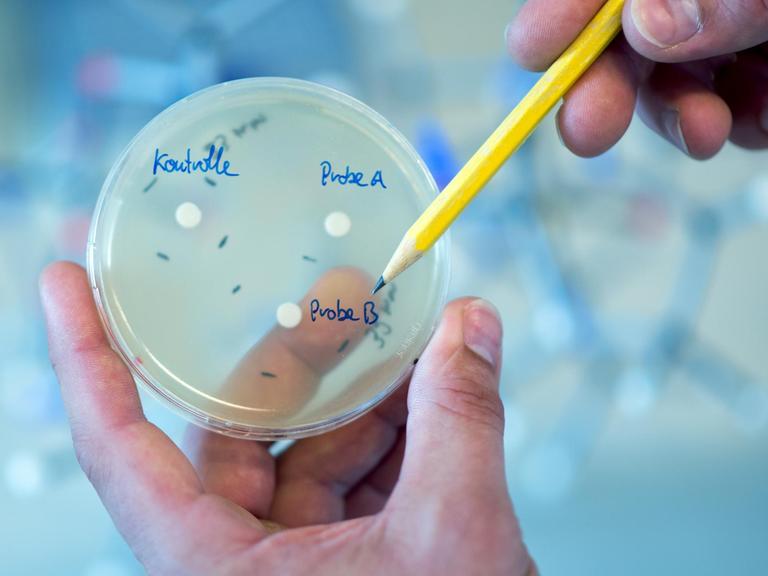
Wenn alles funktioniert, wachsen lauter kleine Zellhaufen: sogenannte Klone, entstanden aus jeweils einer einzelnen Zelle – und jetzt robust genug für das Laborleben. Es geht um die Frage, ob ein Extrakt eines oder mehrerer Klone eine antibiotische Wirkung hat, ob es also in der Lage ist, andere Bakterien abzutöten oder ihr Wachstum zu hemmen.
Petrischalen mit Kulturen: "Das hört sich allerdings einfacher an, als es letztendlich ist", sagt Tanja Schneider.© imago images / Science Photo Library
Die Versuche, die jetzt folgen, sind den Experimenten Flemings gar nicht so unähnlich – nur finden sie in steriler Umgebung statt.
"Im Prinzip tropft man eine Probe, einen Extrakt von diesen Bakterien auf einen Test-Bakterienrasen auf", sagt Tanja Schneider. "Wenn eine antibiotische Wirkung vorliegt, kann man praktisch in diesem Bakterienrasen einen Hemmhof erkennen, in dem die Bakterien dann in ihrem Wachstum gehemmt sind, was ein Indiz dafür ist, dass hier eine antibiotische Wirkung entfaltet wird."
Allerdings passiert auch das nicht einfach so: Fast alle Antibiotika zählen zu den sogenannten Sekundärmetaboliten.
"Also diese meisten Einheiten, die für Antibiotika codieren, sind im Labor stumm", erklärt Tanja Schneider. "Diese Verteidigungsmechanismen, die werden im Labor nicht einfach angeschaltet."
In etwa so, wie auch ein 100-Meter-Läufer nicht jede Strecke im Sprint zurücklegt. Die Forscherinnen und Forscher haben hier mehrere Möglichkeiten: Sie können versuchen, die Bedingungen im Labor so nachzustellen, dass die Bakterien dazu angeregt werden, ihre Antibiotika-Spezial-Ausrüstung auszupacken. Oder sie versuchen zu entschlüsseln, wo im Bakterien-Genom die Bauanleitung für das jeweilige Antibiotikum steht, schneiden sie aus und transferieren sie in ein anderes Bakterium, das weniger wählerisch ist.
Aber auch das hat seine Tücken, sagt Tanja Schneider: "Das hört sich allerdings einfacher an, als es letztendlich ist. Es ist schon sehr komplex. Und das ist auch etwas, wo in der Grundlagenforschung noch dran gearbeitet werden muss, weil man kann nicht jede Biosynthese-Einheit in einen beliebigen Wirt setzen."
Bereits Bekanntes wird immer wieder gefunden
Aber nicht nur deshalb, erzählt Tanja Schneider, bleibt der Puls unten, wenn man – wie einst Alexander Fleming – einen solchen Hemmhof entdeckt.
"Und dann ist es natürlich auch so", sagt sie, "dass wir ganz viele Substanzen, die wir bereits kennen, wiederfinden. Und das ist eines der großen Probleme. Die Substanzen, die wir alle schon seit Jahren kennen – und davon gibt es eine ganze Reihe – die findet man natürlich auch immer wieder. Da muss man erstmal wieder aussortieren, und das ist ein sehr aufwändiger Prozess und minimiert die Erfolgsrate dramatisch."
Neben dem klassischen Screening gibt es weitere Methoden, mit denen nach neuen Antibiotika gesucht wird. Roderich Süssmuth, Professor für Biologische Chemie an der TU Berlin, konnte mit seinem Team ebenfalls eine neue Substanz isolieren. Auch hier handelt es sich um eine völlig neue Wirkstoffklasse – und auch hier war die Zusammenarbeit grenzüberschreitend, diesmal mit einem Labor in Frankreich. Ausgangspunkt war eine Art Bakterien-Datenbank.
"Die Franzosen wussten, sie haben eine interessante Bioaktivität gegen Staphylococcus aureus, allerdings kamen sie in der Strukturaufklärung nicht weiter", erzählt Roderich Süssmuth. "Die haben mich kontaktiert, als Arbeitsgruppe, und wir haben uns dann die Verbindung spektroskopisch angeguckt und konnten die Struktur lösen."
Erfolg dank internationaler Zusammenarbeit
Sie nannten das neu entdeckte Molekül "Microvionin" und suchten weiter.
"Mit diesem Bauplan sind wir dann in Datenbanken gegangen und haben nach ähnlichen Bauplänen gesucht", sagt Roderich Süssmuth, "und haben dann eine ganze Reihe von weiteren verwandten Bauplänen – so 30, 40 weitere verwandte Baupläne gefunden und können jetzt diese vermuteten weiteren Wirkstoffe isolieren - und auf deren antibakterielles Profil durchsuchen."
Eine mikrobiologische Sisyphusarbeit.
"Und das können Sie eigentlich mit durchaus Jahren ansetzen", sagt Roderich Süssmuth. "Und dann werden auch viele wieder durch das Raster fallen."
Die Entwicklung neuer Antibiotika als Medikament kann auf jeder Stufe scheitern – oft schon deshalb, weil sich herausstellt, dass die Substanz nicht nur für die Krankheitserreger giftig ist, sondern auch für menschliche Zellen. Oder die Substanz ist nicht aktiv genug.
Für Wirkstoffe wie "Teixobactin", die diese Hürden genommen haben, geht es etwa um die Fragen, wie stabil die Verbindungen im Körper sind und wie sie den Ort erreichen, an dem sie wirken sollen, erklärt Tanja Schneider.
"Die Antibiotika an sich sind schon besondere Substanzen", sagt sie. "Weil, es ist so, dass sie natürlich im Körper des Menschen wirken müssen und sich dort auch entsprechend verteilen müssen und hier auch Membranen überbrücken müssen. Sie müssen aber dann am Infektionsort gegen die Bakterien wirken. Und hier sind dann wieder ganz andere Kriterien wichtig für das Molekül, um beispielsweise eine Membran zu überbrücken, als das jetzt beispielsweise für die Verteilung im Körper notwendig wäre."
Wenige schaffen es von der Petrischale zum Medikament
Vom Hemmhof in der Petrischale bis zum Medikament schaffen es daher nur wenige der neu entdeckten Substanzen.
"Die Erfolgsrate, eine grampositive Substanz zu finden, die dann auch tatsächlich zugelassen wird, würde ich einschätzen irgendwas zwischen eins und zehn Prozent", sagt Tanja Schneider.
Für gramnegative Bakterien, an die Wirkstoffe schlechter herankommen, schätzt die Mikrobiologin die Chancen noch viel geringer ein. Die Klassifizierung als grampositiv oder gramnegativ geht auf eine Färbemethode zurück: die Gram-Färbung, benannt nach ihrem Erfinder. Viele Bakterien – auch Staphylococcus aureus inklusive seiner resistenten Stämme – lassen sich mit dieser Methode färben.
Bei anderen, etwa Klebsiellen, aber auch Pseudomonaden funktioniert das nicht: Der Farbstoff wäscht sich wieder aus. Deshalb spricht man hier von gramnegativen Keimen. Die Form der Bakterien lässt nicht unbedingt Rückschlüsse darauf zu, um welche Klasse es sich handelt.
Zellwand der Keime ist wichtiges Kriterium
Gebogene Vibrionen und korkenzieherförmige Spirochäten sind gramnegativ. Rrunde Kokken und längliche Stäbchen findet man in beiden Varianten. Die Gram-Klassifizierung sagt viel darüber aus, ob sich ein Bakterium gut mit Antibiotika bekämpfen lässt: Die Zellwand grampositiver Bakterien ist zwar recht dick, aber für viele Substanzen durchlässig.
Zudem sitzen viele der Zielstrukturen von Antibiotika bereits in oder an dieser Membran. Die Zellwand gramnegativer Keime ist im Vergleich komplexer, vor allem aber hat sie eine zusätzliche Membran. Für Substanzen, die in der Zelle wirken sollen, bedeutet das eine zusätzliche Hürde.
Außerdem hat sich herausgestellt, dass gramnegative Bakterien sehr gut darin sind, Antibiotika auszuschalten. Bei vielen Gramnegativen gehören Pumpsysteme innerhalb der Membran zur Grundausstattung – und die sind sehr effizient darin, unerwünschte Moleküle wieder aus der Zelle werfen.
Zahl der Angriffspunkte für Antibiotika begrenzt
Der Präsident der Deutschen Gesellschaft für Hygiene und Mikrobiologie, Georg Häcker, weist auf eine weitere Schwierigkeit hin: "Es ist sicher ein Problem, dass natürlich die Anzahl der Angriffspunkte für Antibiotika einfach endlich ist. Sie können einem Bakterium zum Beispiel die Zellwand angreifen, Sie können die Synthese der lebensnotwendigen Stoffe angreifen, aber irgendwann haben sie alles angegriffen. Und bei den Gramnegativen, da haben wir schon viele dieser Punkte angegriffen. Es wird schwierig sein, hier neue Angriffspunkte zu identifizieren und dann auch die so zu inhibieren, dass das Bakterium beeinträchtigt wird, dass der Mensch nicht beeinträchtigt wird und auch, dass das Bakterium nicht sofort Resistenzen entwickeln kann."
Als Konsequenz betrachtet Georg Häcker solche Keime mittlerweile als vorrangiges Problem und nennt insbesondere multiresistente Enterobakterien als Beispiel, zu denen auch Klebsiellen gehören.
Auch für Tanja Schneider haben grampositive Erreger in der Klinik viel von ihrem Schrecken verloren: "Wir haben immer noch ein gewisses Level an den Kliniken mit MRSA, aber vor allem auch durch Prävention und entsprechende Hygienemaßnahmen ist das Problem mit den MRSA auf einem stetigen Level geblieben. Die Situation derzeit an den Kliniken ist allerdings die, dass die gramnegativen Keime mit ausgeprägten Multiresistenzen hier eigentlich ein viel größeres Problem sind, wo wir ganz dringend neue Antibiotika brauchen, weil hier gibt es mittlerweile Keime, da wirkt keine einzige Substanz, die wir derzeit verfügbar hätten, mehr. Und diesen Patienten kann man dann letztlich auch nicht mehr helfen."
Strategien gegen resistente oder gramnegative Erreger
Tragische Fälle wie jener der US-Amerikanerin, die an einer Infektion pan-resistenter Klebsiellen starb, bei der sämtliche derzeit verfügbare Antibiotika nicht wirkten. Und dennoch: Völlig machtlos sind Ärzte und Wissenschaftler nicht. Auch gegen gramnegative Keime werden neue Substanzen - etwa Cystobactamide - chemisch optimiert und auf eine mögliche Anwendung bei Menschen hin untersucht.
Und in der Klinik kann man zum Beispiel Antibiotika wieder wirksam machen, obwohl es bereits Resistenzen gegen sie gibt. Der Patient bekommt dann mehrere Wirkstoffe gleichzeitig, von denen einige nur die Resistenzmechanismen angreifen und so dem Antibiotikum den Weg frei machen.
Oder die Ärzte versuchen, den Bakterien das Leben schwer zu machen. Das Prinzip dahinter: entwaffnen statt töten. Ziel ist es, die Erreger während der Infektion so zu stören, dass sie nicht in der Lage sind, Unheil anzurichten. Entwickelt werden solche Anti-Virulenz-Strategien etwa am Helmholtz-Zentrum für Infektionsforschung.
Die Kommunikation der Bakterienzellen stören
Die Wissenschaftlerinnen und Wissenschaftler versuchen etwa zu verhindern, dass sich Bakterien an der Schleimhaut festhalten oder sie stören die Kommunikation der Bakterienzellen untereinander. Für das Immunsystem wäre es wesentlich leichter, eine solche Infektion zu bekämpfen und letztlich zu besiegen. Bis zur praktischen Anwendung ist es aber noch ein weiter Weg.
Dazu kommt: Für Pharmaunternehmen ist die Entwicklung neuer Antibiotika oft wenig lukrativ. Geld verdienen lässt sich vor allem mit Medikamenten gegen Krankheiten wie Diabetes oder Krebs, die langfristig behandelt werden müssen. Ein effektives Antibiotikum dagegen tötet die Erreger, gegen die es wirkt, innerhalb weniger Tage.
Darüber hinaus werden einige der neu entwickelten Wirkstoffe als Reserve-Antibiotika für einen Einsatz bei Infektionen mit multiresistenten Keimen zurückgehalten.
Desinfizierung im Eingangsbereich einer Klinik: Manchen Patienten können auch nicht antibiotikaresistente Erreger zum Verhängnis werden.© dpa / Sebastian Gollnow
Für die gegenwärtige Situation ist Zeit ein entscheidender Faktor, meint Georg Häcker. Denn Patienten, deren Immunsystem geschwächt ist – etwa nach einer Transplantation oder durch eine Tumorerkrankung – können auch nicht antibiotikaresistente Erreger zum Verhängnis werden.
"Wenn ein Patient in die Klinik kommt", sagt Georg Häcker, "dann muss ich in der Lage sein, schnell zu sehen: Hat der eine bakterielle Infektion, kann ich diese Infektion mit einem Antibiotikum, und mit welchem therapieren, mit welcher Dosierung, wie lange. Und ich muss verhindern können, dass diese Bakterien von diesen Patienten auf den nächsten übertragen werden können. Und dafür gibt es Spezialisten und diese sind extrem wichtig."
WHO: Antibiotikaresistenzen bedrohen globale Gesundheit
Die Weltgesundheitsorganisation rechnet Antibiotikaresistenzen zu den zehn größten Bedrohungen für die globale Gesundheit. Sie hat einen Katalog mit Empfehlungen herausgegeben, mit denen Infektionen während einer Operation vermieden werden sollen: die Patienten vor dem Eingriff in jedem Fall waschen, am besten mit antibakterieller Seife. Störende Körperhaare mit der Schere entfernen statt sie abzurasieren, um so offene Wunden zu vermeiden, in die Keime eindringen können. Und Antibiotika – anders als bisher – nach einem Eingriff nicht mehr vorsorglich zu verabreichen, sondern nur dann, wenn tatsächlich eine bakterielle Infektion vorliegt.
In Deutschland deutet einiges darauf hin, dass der Antibiotika-Gebrauch inzwischen stärker überdacht wird: Die Zahl der Verschreibungen sinkt seit Jahren, nach Zahlen des Zentralinstituts für die kassenärztliche Versorgung wurden 2018 gut einem Fünftel weniger entsprechende Rezepte ausgestellt als noch 2010.
In der Forschung hält Tanja Schneider es für entscheidend, sehr genau zu analysieren, was in und an der Zelle passiert: "Wir wollen letztlich verstehen, wie funktioniert die Bakterienzelle, wie funktionieren bestimmte Prozesse in der Bakterienzelle, um letztlich zu verstehen, was macht ein Antibiotikum, wo muss man letztlich ansetzen, an welchem Rädchen muss man in diesem Biosynthesekreislauf drehen, damit man hier möglicherweise eine geeignete Zielstruktur für ein Antibiotikum finden kann."
Und dann gibt es ja noch den Zufall, der schon für Alexander Fleming der entscheidende Faktor war.
Gemeinsame Forschung dank eines Zufalls
Auch Tanja Schneider zog im richtigen Moment die richtigen Schlüsse: "Auf einer Konferenz habe ich einen Vortrag gehört von Doktor Kim Lewis aus Boston, und der hat hier eine Substanz präsentiert unter anderem, das war dann später das Teixobactin, und diese Struktur hatte Ähnlichkeit mit Substanzen, mit denen wir vorher schon gearbeitet hatten, und irgendwie roch das für mich, nach einer Substanz, die in die Zellwand-Biosynthese von grampositiven Bakterien eingreift . Ich habe gedacht, diese Substanz ist eigentlich prädestiniert dafür, dieses oder jenes zu tun. Und dann bin ich dann nach dem Vortrag zu Kim Lewis hin und habe ihm gesagt, also das wäre eine schöne Substanz, und ich könnte mir gut vorstellen, dass ich jetzt wüsste, wie sie wirkt. Und daraufhin hat er, glaube ich, gedacht, ich hätte zu viel Alkohol getrunken. Hatte ich aber nicht. Und es hat dann tatsächlich zwei Monate gedauert, bis ich ihn überzeugt habe, dass wir uns das vielleicht noch mal anschauen."
Es folgten: ein Päckchen mit einer Probe des mutmaßlichen Zielmoleküls von Bonn nach Boston, weitere Experimente und – auf Bostoner Seite – großes Erstaunen.
"Er hat dann eine E-Mail geschrieben und gesagt, er könnte es überhaupt gar nicht glauben, aber es wäre tatsächlich so, wie ich das vorhergesagt hab. Dass die Substanz genau das tut, was ich dachte, dass sie tut. Das war dann praktisch der Startschuss für unsere Kooperation. Und dann haben wir den Wirkmechanismus dann gemeinsam vollständig aufgeklärt."
Und wer hat im Wettlauf zwischen Resistenzen und Gegenmitteln die Nase vorn? Louis Pasteur, der als Vater der Mikrobiologie gilt, hatte auf diese Frage schon vor mehr als 100 Jahren eine Antwort: "Mikroben werden immer das letzte Wort haben."
Bis dahin aber machen Wissenschaftler weltweit den Krankheitserregern unter ihnen das Leben noch sehr, sehr schwer. Hoffentlich erfolgreich.